RBSE Class 11 Chemistry Important Questions Chapter 6 ऊष्मागतिकी
Rajasthan Board RBSE Class 11 Chemistry Important Questions Chapter 6 ऊष्मागतिकी Important Questions and Answers.
RBSE Class 11 Chemistry Chapter 6 Important Questions ऊष्मागतिकी
बहुचयनात्मक प्रश्न (Multiple Choice Questions):
प्रश्न 1.
निम्न में से कौनसा समीकरण CH4 की मानक संभवन ऊष्मा को प्रदर्शित करता है:
(अ) C(हीरा) + 2H2(g) → CH4(g)
(ब) C(ग्रेफाइट) + 2H2(g) → CH4(g)
(स) C(हीरा) + 4H(g) → CH4(g)
(द) C(ग्रेफाइट) + H2(g) → CH4(g)
उत्तर:
(ब) C(ग्रेफाइट) + 2H2(g) → CH4(g)
प्रश्न 2.
स्थिर ताप व दाव पर एक रासायनिक अभिक्रिया में होने वाले ऊष्मा परिवर्तन को कहते हैं:
(अ) एन्ट्रॉपी
(ब) मुक्त ऊर्जा
(स) आन्तरिक ऊर्जा
(द) एन्थैल्पी
उत्तर:
(द) एन्थैल्पी

प्रश्न 3.
किसी तन्त्र में एन्थैल्पी परिवर्तन (AH) किस पर निर्भर करता है?
(अ) प्राथमिक अवस्था पर (ब) अन्तिम अवस्था पर
(ब) अन्तिम अवस्था पर
(स) प्राथमिक तथा अन्तिम दोनों अवस्थाओं पर
(द) उपर्युक्त में से कोई नहीं।
उत्तर:
(स) प्राथमिक तथा अन्तिम दोनों अवस्थाओं पर
प्रश्न 4.
निम्न में से किस प्रक्रम में एन्ट्रॉपी नहीं बढ़ती?
(अ) विलयन से शर्करा का क्रिस्टलीकरण
(ब) कपूर का वाष्पीकरण
(स) गैसों का मिश्रण बनना
(द) उपर्युक्त सभी
उत्तर:
(अ) विलयन से शर्करा का क्रिस्टलीकरण
प्रश्न 5.
किसी ऊष्माशोषी अभिक्रिया के लिए ∆S = +ve है तो अभिक्रिया तभी सम्भव होगी जब
(अ) T∆S > ∆H
(ब) ∆H > T∆S
(स) सभी ताप पर सम्भव
(द) किसी भी ताप पर सम्भव नहीं
उत्तर:
(अ) T∆S > ∆H
प्रश्न 6.
ऊष्मागतिकी में एक प्रक्रम उत्क्रमणीय होता है जब
(अ) परिवेश तथा तन्त्र एक-दूसरे में परिवर्तित होते हों
(ब) परिवेश, तन्त्र के साथ सदैव साम्य में हो
(स) तन्त्र तथा परिवेश में कोई परिसीमा नहीं हो
(द) उपर्युक्त में से कोई नहीं ऊष्मागतिकी
उत्तर:
(ब) परिवेश, तन्त्र के साथ सदैव साम्य में हो
प्रश्न 7.
एक अभिक्रिया A + B → C+ D+ q के लिए एन्ट्रॉपी परिवर्तन धनात्मक है तो यह अभिक्रिया सम्भव है-
(अ) उच्च ताप पर
(ब) निम्न ताप पर
(स) किसी भी ताप पर
(द) किसी भी ताप पर नहीं
उत्तर:
(ब) निम्न ताप पर
प्रश्न 8.
निम्नलिखित में से किस प्रक्रम में निकाय का ताप कम होता है:
(अ) गैसों का रुद्धोष्म संपीडन
(ब) किसी गैस का रुद्धोष्म प्रसार
(स) किसी गैस का समतापीय संपीडन
(द) किसी गैस का समतापीय प्रसार
उत्तर:
(ब) किसी गैस का रुद्धोष्म प्रसार
प्रश्न 9.
अभिक्रिया C6H6(l) + 15O2 → 6 CO2 + 3H2O(l) में एन्थैल्पी परिवर्तन है:
(अ) वाष्पन एन्थैल्पी
(ब) दहन एन्थैल्पी
(स) संभवन एन्थैल्पी
(द) गलन एन्थैल्पी
उत्तर:
(ब) दहन एन्थैल्पी
प्रश्न 10.
स्वतः प्रक्रम होते हैं:
(अ) साम्यावस्था में
(ब) उत्क्रमणीय
(स) अनुत्क्रमणीय
(द) उपर्युक्त में से कोई नहीं
उत्तर:
(स) अनुत्क्रमणीय
प्रश्न 11.
किरचॉफ समीकरण के अनुसार निम्न में से कौनसा कारक अभिक्रिया एन्थैल्पी को प्रभावित करता है:
(अ) आयतन
(ब) दाब
(स) ताप
(द) उपर्युक्त में से कोई नहीं
उत्तर:
(स) ताप
प्रश्न 12.
यदि H+ + OH- → H2O + 57.32 kJ है तो एक मोल HCl को एक मोल NaOH द्वारा उदासीन करने पर उत्सर्जित ऊष्मा होगी:
(अ) 57.32 x 2kJ
(ब) 57.32 x 4kJ
(स) 28.66 KJ
(द) 57.32 kJ
उत्तर:
(द) 57.32 kJ

प्रश्न 13.
373 K ताप तथा एक वायुमण्डलीय दाब पर जल को वाष्प में परिवर्तित करने पर ∆G = 0 है इससे ज्ञात होता है:
(अ) जलवाष्प 373 K ताप पर स्वतः संघनित होती है।
(ब) H2O(l) तथा H2O(g) साम्यावस्था में हैं।
(स) जल 373 K पर स्वतः उबलता है।
(द) उपर्युक्त में से कोई नहीं
उत्तर:
(ब) H2O(l) तथा H2O(g) साम्यावस्था में हैं।
रिक्त स्थान वाले प्रश्न (Fill in the blanks):
प्रश्न 1.
थर्मस फ्लास्क में रखा गर्म दूध एक ................ निकाय है।
उत्तर:
विलगित
प्रश्न 2.
वह ऊर्जा विनिमय जो ताप में अन्तर के कारण होता है, उसे ..................... कहा जाता है।
उत्तर:
ऊष्मा
प्रश्न 3.
भौतिक तथा रासायनिक प्रक्रमों से सम्बन्धित ऊर्जा परिवर्तनों को ........................ ज्ञात करने के लिए आवश्यक उपकरण को हैं।
उत्तर:
कैलोरीमीटर
प्रश्न 4.
परम शून्य ताप पर शुद्ध तथा पूर्णतः क्रिस्टलीय ठोस पदार्थ की एन्ट्रॉपी का मान ......................... होता है।
उत्तर:
शून्य
प्रश्न 5.
किसी निकाय की एन्थैल्पी स्थिर दाब पर उसकी ........................ होती है।
उत्तर:
ऊष्मा
अन्तर्वस्तु
प्रश्न 6.
किसी निकाय की रासायनिक, वैद्युत तथा यांत्रिक ऊर्जा का योग ............................ कहलाती है।
उत्तर:
आन्तरिक ऊर्जा

प्रश्न 7.
उत्क्रमणीय प्रक्रमों के लिए ∆S = ..................... है।
उत्तर:
qrev/T
प्रश्न 8.
ऊष्माक्षेपी अभिक्रियाओं के लिए ∆H ....................... होता है।
उत्तर:
ऋणात्मक
प्रश्न 9.
वे गुण जो निकाय में उपस्थित द्रव्य की मात्रा पर निर्भर नहीं करते, उन्हें ............................ कहते हैं।
उत्तर:
गहन गुण।
निम्नलिखित में से सत्य एवं असत्य कथन छाँटिए (True and False Statement):
प्रश्न 1.
ब्रह्माण्ड की एन्ट्रॉपी लगातार बढ़ रही है।
उत्तर:
सत्य
प्रश्न 2.
एक बंद पात्र में रखा गर्म जल एक विलगित निकाय है।
उत्तर:
असत्य
प्रश्न 3.
रुद्धोष्म प्रक्रम के लिए dg = शून्य होता है।
उत्तर:
सत्य
प्रश्न 4.
ऊष्मा एक अवस्था फलन है।
उत्तर:
असत्य
प्रश्न 5.
एक विलगित निकाय की ऊर्जा स्थिर होती है।
उत्तर:
सत्य

प्रश्न 6.
वे गुण जिनका मान निकाय में उपस्थित द्रव्य की मात्रा तथा आकार पर निर्भर करता है, उन्हें गहन गुण (मात्रा स्वतन्त्र) कहते हैं ।
उत्तर:
असत्य
प्रश्न 7.
आन्तरिक ऊर्जा एक विस्तीर्ण गुण है।
उत्तर:
सत्य
प्रश्न 8.
हीरे की अपेक्षा ग्रेफाइट अधिक स्थायी होता है।
उत्तर:
सत्य
मिलान करने वाले प्रश्न (Matching type Questions)
सूची A तथा सूची B का मिलान कीजिए तथा सही कूट (Code) का चयन कीजिए:
प्रश्न 1.
|
सूची A |
सूची B |
|
(1) ∆Hg |
(a) R |
|
(2) Cp - Cv |
(b) निकाय + परिवेश |
|
(3) ऊर्जा संरक्षण का नियम |
(c) ∆H + ∆Hv |
|
(4) ब्रह्माण्ड |
(d) ऊष्मागतिकी का प्रथम नियम |
उत्तर:
|
सूची A |
सूची B |
|
(1) ∆Hg |
(c) ∆H + ∆Hv |
|
(2) Cp - Cv |
(a) R |
|
(3) ऊर्जा संरक्षण का नियम |
(d) ऊष्मागतिकी का प्रथम नियम |
|
(4) ब्रह्माण्ड |
(b) निकाय + परिवेश |
प्रश्न 2.
|
सूची A |
सूची B |
|
(1) समआयतनी प्रक्रम |
(a) शून्य |
|
(2) ऊष्मागतिकी का प्रथम नियम |
(b) dV = 0 |
|
(3) घनत्व |
(c) ∆U = q + W |
|
(4) किसी तत्व की मानक अवस्था में विरचन एन्थैल्पी |
(d) मात्रा स्वतंत्र गुण |
उत्तर:
|
सूची A |
सूची B |
|
(1) समआयतनी प्रक्रम |
(b) dV = 0 |
|
(2) ऊष्मागतिकी का प्रथम नियम |
(c) ∆U = q + W |
|
(3) घनत्व |
(d) मात्रा स्वतंत्र गुण |
|
(4) किसी तत्व की मानक अवस्था में विरचन एन्थैल्पी |
(a) शून्य |

प्रश्न 3.
|
सूची A |
सूची B |
|
(1) पदार्थ की मानक अवस्था |
(a) ∆G = ∆H - T∆S |
|
(2) ऊर्ध्वपातन की एन्ट्रॉपी |
(b) 1 वायुमण्डलीय दाब तथा 298 K ताप |
|
(3) गिब्स समीकरण |
(c) अक्रिस्टलीय |
|
(4) काँच |
(d) ∆S (sub) = ∆H (rub)/T |
उत्तर:
|
सूची A |
सूची B |
|
(1) पदार्थ की मानक अवस्था |
(b) 1 वायुमण्डलीय दाब तथा 298 K ताप |
|
(2) ऊर्ध्वपातन की एन्ट्रॉपी |
(d) ∆S (sub) = ∆H (rub)/T |
|
(3) गिब्स समीकरण |
(a) ∆G = ∆H - T∆S |
|
(4) काँच |
(c) अक्रिस्टलीय |
प्रश्न 4.
|
सूची A |
सूची B |
|
(1) स्वतः प्रवर्तित प्रक्रम |
(a) बर्फ का जल में बदलना |
|
(2) एन्ट्रॉपी |
(b) ∆G ऋणात्मक |
|
(3) यांत्रिक ऊर्जा |
(c) निकाय की अव्यवस्था का माप |
|
(4) समतापीय प्रक्रम |
(d) यांत्रिक ऊर्जा का गतिज ऊर्जा में परिवर्तन |
उत्तर:
|
सूची A |
सूची B |
|
(1) स्वतः प्रवर्तित प्रक्रम |
(b) ∆G ऋणात्मक |
|
(2) एन्ट्रॉपी |
(c) निकाय की अव्यवस्था का माप |
|
(3) यांत्रिक ऊर्जा |
(d) यांत्रिक ऊर्जा का गतिज ऊर्जा में परिवर्तन |
|
(4) समतापीय प्रक्रम |
(a) बर्फ का जल में बदलना |
प्रश्न 5.
|
सूची A |
सूची B |
|
(1) समतापीय उत्क्रमणीय प्रक्रमा के लिए |
(a) दहन ऊष्मा का निर्धारण |
|
(2) साम्यावस्था पर एन्ट्रॉपीपरिवर्तन |
(b) Wrev = - 2.303 nRT log Vf/Vi |
|
(3) आदर्श प्रक्रम |
(c) ∆S = 0 |
|
(4) बम कैलोरीमीटर |
(d) उत्क्रमणीय प्रक्रम |
उत्तर:
|
सूची A |
सूची B |
|
(1) समतापीय उत्क्रमणीय प्रक्रमा के लिए |
(b) Wrev = - 2.303 nRT log Vf/Vi |
|
(2) साम्यावस्था पर एन्ट्रॉपीपरिवर्तन |
(c) ∆S = 0 |
|
(3) आदर्श प्रक्रम |
(d) उत्क्रमणीय प्रक्रम |
|
(4) बम कैलोरीमीटर |
(a) दहन ऊष्मा का निर्धारण |
प्रश्न 6.
|
सूची A |
सूची B |
|
(1) विलयन एन्थैल्पी |
(a) अनुत्क्रमणीय प्रक्रम |
|
(2) आयतन |
(b) एन्ट्रॉपी कम होना |
|
(3) स्वतः प्रक्रम |
(c) जलयोजन एन्थैल्पी विलायकन एन्थैल्पी |
|
(4) विलयन से शर्करा का क्रिस्टलीकरण |
(d) विस्तीर्ण गुण |
उत्तर:
|
सूची A |
सूची B |
|
(1) विलयन एन्थैल्पी |
(c) जलयोजन एन्थैल्पी विलायकन एन्थैल्पी |
|
(2) आयतन |
(d) विस्तीर्ण गुण |
|
(3) स्वतः प्रक्रम |
(a) अनुत्क्रमणीय प्रक्रम |
|
(4) विलयन से शर्करा का क्रिस्टलीकरण |
(b) एन्ट्रॉपी कम होना |

प्रश्न 7.
|
सूची A |
सूची B |
|
(1) HCl + NaOH की उदासीनीकरण ऊष्मा |
(a) ताप में अन्तर के कारण ऊर्जा विनिमय |
|
(2) गैसों का मिश्रण बनना |
(b) 57.32 kJ |
|
(3) ∆G > 0 |
(c) एन्ट्रॉपी का बढ़ना |
|
(4) ऊष्मा |
(d) प्रक्रम अस्वतः प्रवर्तित |
उत्तर:
|
सूची A |
सूची B |
|
(1) HCl + NaOH की उदासीनीकरण ऊष्मा |
(b) 57.32 kJ |
|
(2) गैसों का मिश्रण बनना |
(c) एन्ट्रॉपी का बढ़ना |
|
(3) ∆G > 0 |
(d) प्रक्रम अस्वतः प्रवर्तित |
|
(4) ऊष्मा |
(a) ताप में अन्तर के कारण ऊर्जा विनिमय |
अतिलघूत्तरात्मक प्रश्न (Very Short Answer Type Questions):
प्रश्न 1.
ऊष्मागतिकी का शून्य नियम क्या है?
उत्तर:
यदि दो वस्तुएँ A व B अलग-अलग किसी अन्य तीसरी वस्तु C के साथ ऊष्मीय साम्य में हों तो A तथा B सम्पर्क में आने पर ये भी परस्पर ऊष्मीय साम्य में होंगी।
प्रश्न 2.
विलगित निकाय का एक उदाहरण बताइए।
उत्तर:
थर्मस फ्लास्क में रखा गर्म दूध एक विलगित निकाय है।
प्रश्न 3.
कौनसा प्रक्रम आदर्श प्रक्रम होता है?
उत्तर:
उत्क्रमणीय प्रक्रम आदर्श प्रक्रम होता है।
प्रश्न 4.
दहन ऊष्मा का निर्धारण किस उपकरण द्वारा किया जाता है?
उत्तर:
बम कैलोरीमीटर द्वारा।
प्रश्न 5.
हीरे की मानक सम्भवन ऊष्मा शून्य नहीं होती है जबकि यह भी एक तत्व है, क्यों?
उत्तर:
किसी तत्व के विभिन्न अपररूपों में केवल अधिकतम स्थायी रूप की मानक सम्भवन ऊष्मा ही शून्य होती है चूँकि ग्रेफाइट, हीरे से अधिक स्थायी है। अतः हीरे की मानक सम्भवन ऊष्मा शून्य होती।
प्रश्न 6.
ऊष्मा रसायन किसे कहते हैं?
उत्तर:
भौतिक रसायन की वह शाखा जिसमें रासायनिक अभिक्रियाओं में होने वाले ऊष्मा परिवर्तन का अध्ययन किया जाता है, उसे ऊष्मा रसायन कहते हैं।

प्रश्न 7.
ऊष्माधारिता की परिभाषा बताइए।
उत्तर:
किसी निकाय या द्रव्य के ताप को एक डिग्री सेल्शियस या एक केल्विन बढ़ाने के लिए आवश्यक ऊष्मा को उस निकाय की ऊष्माधारिता कहते हैं।
प्रश्न 8.
बर्फ के टुकड़े को छूने पर हमें ठण्डक क्यों महसूस होती है?
उत्तर:
बर्फ के टुकड़े का ताप हमारे शरीर के ताप से कम होता अतः बर्फ हमारे शरीर से ऊष्मा अवशोषित करती है जिससे हमें ठण्डक महसूस होती है।
प्रश्न 9.
किसी निकाय के एन्थैल्पी परिवर्तन (∆H) तथा आन्तरिक ऊर्जा में परिवर्तन (∆U) में सम्बन्ध लिखिये।
उत्तर-
∆H = ∆U + P∆V
P = दाब, ∆V = आयतन में परिवर्तन
प्रश्न 10.
कोई विस्तीर्ण गुण कब गहन गुण हो जाता है?
उत्तर:
द्रव्य की इकाई मात्रा के लिए विस्तीर्ण गुण गहन गुण हो जाता है, जैसे- घनत्व।
प्रश्न 11.
HCl की उदासीनीकरण एन्थैल्पी, H2SO4 की उदासीनीकरण एन्थैल्पी के बराबर होती है, क्यों?
उत्तर:
HCl तथा H2SO4 दोनों ही प्रबल अम्ल हैं अतः दोनों का पूर्ण आयनन हो जाता है।
प्रश्न 12.
जलीय विलयन में Mg2+ की एन्ट्रॉपी, जलयोजन से पहले अधिक होगी या बाद में।
उत्तर:
जलीय विलयन में Mg2+ आयन की एन्ट्रॉपी जलयोजन के पहले अधिक होगी क्योंकि जलयोजन से Mg2+ का आकार बढ़ जाता है अतः एन्ट्रॉपी कम हो जाती है।
प्रश्न 13.
उदासीनीकरण ऊष्मा किसे कहते हैं?
उत्तर:
एक ग्राम तुल्यांक अम्ल तथा एक ग्राम तुल्यांक क्षार के जलीय विलयनों की क्रिया से लवण तथा जल बनने पर ( उदासीनीकरण अभिक्रिया) उत्सर्जित ऊष्मा को उदासीनीकरण ऊष्मा कहते हैं।
प्रश्न 14.
किसी रासायनिक अभिक्रिया के लिए ∆H तथा ∆U कब समान होंगे?
उत्तर:
किसी रासायनिक अभिक्रिया में जब गैसीय उत्पादों तथा गैसीय अभिकारकों के मोल समान होते हैं तब ∆H तथा ∆U समान होंगे।
प्रश्न 15.
H2O (l) 300 K तथा H2O(l) 450K में से किसकी एन्ट्रॉपी अधिक होगी तथा क्यों?
उत्तर:
H2O(l) 450 K की एन्ट्रॉपी अधिक होगी क्योंकि ताप के बढ़ने पर अणुओं की अव्यवस्था बढ़ती है।
लघूत्तरात्मक प्रश्न (Short Answer Type Questions):
प्रश्न 1.
किसी निकाय की अवस्था (State of the System) से क्या तात्पर्य है ? समझाइए।
उत्तर:
किसी ऊष्मागतिकी निकाय का वर्णन उसके दाब (P), आयतन (V), ताप (T) तथा निकाय के संघटन से किया जाता है। इन गुणों को निकाय में परिवर्तन से पहले तथा परिवर्तन के पश्चात् ज्ञात करते हैं। निकाय के लिए दाब, आयतन, ताप तथा मात्रा मापन योग्य (स्थूल गुण) हैं। किसी गैस की अवस्था का वर्णन उसके दाब, आयतन, ताप तथा मात्रा (n) से कर सकते हैं। दाब आयतन तथा ताप को अवस्था फलन कहते हैं क्योंकि इनका मान निकाय की अवस्था पर निर्भर करता है न कि इसके पहुँचने के तरीके पर। किसी निकाय की अवस्था को परिभाषित करने के लिए निकाय के सभी गुणों की आवश्यकता नहीं होती क्योंकि कुछ गुण ही स्वतंत्र रूप में परिवर्तित हो सकते हैं। इन गुणों की संख्या निकाय की प्रकृति पर निर्भर करती है। जब किसी निकाय के लिए P, V, T तथा n का मान निश्चित हो जाता है तो इसे निकाय की एक अवस्था कहते हैं अर्थात् इन गुणों में परिवर्तन से निकाय की अवस्था परिवर्तित हो जाती है।

प्रश्न 2.
विस्तीर्ण गुण तथा गहन गुण में क्या अन्तर है? समझाइये।
उत्तर:
विस्तीर्ण गुण: विस्तीर्ण गुण वे गुण होते हैं जिनका मान निकाय में उपस्थित द्रव्य की मात्रा तथा आकार पर निर्भर करता है। उदाहरण- द्रव्यमान, आयतन, आन्तरिक ऊर्जा, एन्थैल्पी, ऊष्माधारिता इत्यादि।
गहन गुण: वे गुण, जो निकाय में उपस्थित द्रव्य की मात्रा तथा आकार पर निर्भर नहीं करते हैं लेकिन द्रव्य की प्रकृति पर निर्भर करते हैं, गहन गुण कहलाते हैं। उदाहरण - ताप, घनत्व, दाब इत्यादि। जब द्रव्य इकाई मात्रा में उपस्थित होता है तो विस्तीर्ण गुण, गहन गुण हो जाते हैं। अर्थात् दो विस्तीर्ण गुणों का अनुपात गहन गुण होता है, जैसे द्रव्यमान तथा आयतन विस्तीर्ण गुण हैं लेकिन इन दोनों का अनुपात (घनत्व) एक गहन गुण है।
प्रश्न 3.
मोलर ऊष्माधारिता तथा विशिष्ट ऊष्माधारिता की व्याख्या कीजिये।
उत्तर:
मोलर ऊष्माधारिता: किसी पदार्थ के एक मोल पदार्थ का ताप 1°C या 1 केल्विन बढ़ाने के लिए आवश्यक ऊष्मा को मोलर ऊष्माधारिता कहते हैं अर्थात् यह एक मोल पदार्थ की ऊष्माधारिता है।
\(\mathrm{C}_{\mathrm{m}}=\frac{\mathrm{C}}{\mathrm{n}}\)
n = मोलों की संख्या
विशिष्ट ऊष्मा या विशिष्ट ऊष्माधारिता (C): ऊष्मा की वह मात्रा जो इकाई द्रव्यमान (जैसे 1 ग्राम) के किसी पदार्थ का ताप 1° सेल्शियस बढ़ाने के लिए आवश्यक होती है, उसे विशिष्ट ऊष्माधारिता कहते हैं।
किसी पदार्थ का ताप बढ़ाने के लिए आवश्यक ऊष्मा (q)
या
q = c x m x ∆T
q = C∆T (यहाँ C = cm)
m = पदार्थ का द्रव्यमान, ∆T = ताप में परिवर्तन तथा = विशिष्ट ऊष्मा।
प्रश्न 4.
कैलोरीमिति किसे कहते हैं तथा बम कैलोरीमीटर द्वारा आन्तरिक ऊर्जा में परिवर्तन (∆U) का मापन किस प्रकार किया जाता है ? समझाइयें।
उत्तर:
(i) ∆U का मापन (qv) या स्थिर आयतन पर आन्तरिक ऊर्जा में परिवर्तन का मापन-रासायनिक प्रक्रमों के लिए स्थिर आयतन पर अवशोषित ऊष्मा का मापन बम कैलोरीमीटर में किया जाता है (चित्र) इसमें एक स्टील या ताँबे का एक पात्र होता है जो कि जल में डूबा होता है। इस पात्र।
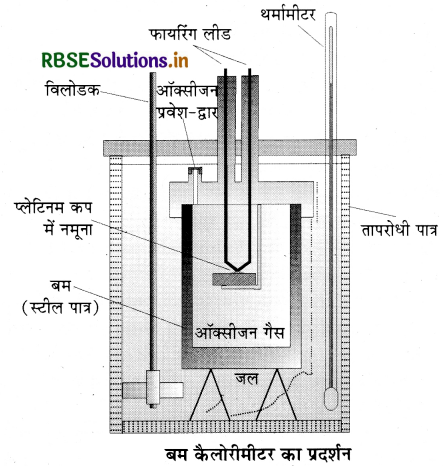
को बम कहा जाता है। बम में ऑक्सीजन प्रवाहित करके ज्वलनशील नमूने (Sample) को जलाया जाता है। अभिक्रिया में उत्पन्न ऊष्मा जल को स्थानान्तरित हो जाती है। इसके पश्चात्. जल का ताप ज्ञात कर लेते हैं। चूँकि बम कैलोरीमीटर बन्द होता है अतः आयतन में परिवर्तन (ΔV) = 0 इसलिए कोई कार्य नहीं होता। कैलोरीमीटर की ऊष्माधारिता ज्ञात होने पर qV की गणना निम्न सूत्र से की जा सकती है:
qv = CvΔT
qv = c x m x ΔT
प्रश्न 5.
स्थिर दाब पर ऊष्मा परिवर्तन (∆H) के मापन की प्रायोगिक विधि का वर्णन कीजिये।
उत्तर:
मापन-सामान्यतः ऊष्मा परिवर्तन का मापन वायुमण्डलीय दाब पर किया जाता है। इसके लिए एक कैलोरीमीटर प्रयुक्त किया जाता है जिसे चित्र में दर्शाया गया है। इसमें थर्मस फ्लास्क जैसा एक पात्र होता है जो कि तापरोधी होता है तथा इसमें एक थर्मामीटर लगा होता है। इस पात्र में अभिक्रिया सम्पन्न होती है।

प्रश्न 6.
अभिक्रिया की मानक एन्थैल्पी क्या होती है? समझाइए।
उत्तर:
अभिक्रिया की मानक एन्थैल्पी (∆H°) - किसी रासायनिक अभिक्रिया की मानक एन्थैल्पी वह एन्थैल्पी परिवर्तन होता है, जब उस अभिक्रिया में भाग लेने वाले सभी पदार्थ अपनी मानक अवस्थाओं में हों। किसी पदार्थ की मानक अवस्था किसी विशिष्ट ताप पर उसका वह शुद्ध रूप है, जो 1 bar दाब पर पाया जाता है। उदाहरण: द्रव एथेनॉल की मानक अवस्था 298 K ताप तथा 1 bar दाब पर शुद्ध द्रव होती है।
प्रश्न 7.
समीकरण ∆H = ∆U + ∆ngRT की व्युत्पत्ति (Derivation ) कीजिए।
उत्तर:
किसी गैसीय अभिक्रिया के लिए यदि स्थिर दाब तथा ताप पर VA अभिकारकों का तथा VB उत्पादों का कुल आयतन हो तथा nA अभिकारकों तथा AB उत्पादों के मोलों की संख्या हो, तो आदर्श गैस समीकरण के अनुसार:
PVA = nART
तथा
PVB = nBRT
या
PVB - pVA = nBRT - nART = (nB - nA) RT
p (VB - VA) = (nB - nA) RT
p ∆V = ∆ngRT
∆ng = गैसीय उत्पादों के मोलों की संख्या - गैसीय अभिकारकों के मोलों की संख्या
इस समीकरण से P∆V का मान समीकरण ∆H = ∆V + D∆V में रखने पर
∆H = ∆U + ∆ngRT

प्रश्न 8.
मानक विरचन एन्थैल्पी को उदाहरण सहित समझाइए।
उत्तर:
मानक विरचन एन्थैल्पी (∆H°): किसी यौगिक के एक मोल को उसके अवयवी तत्त्वों, जो अपने सबसे स्थायी रूपों में लिये गए हैं, में से विरचित करने पर होने वाले मानक एन्थैल्पी परिवर्तन को उसकी मानक विरचन एन्थैल्पी कहते हैं। यहाँ पादांक 'f' यह बताता है कि संबंधित यौगिक का एक मोल उसके तत्त्वों, जो अपने सबसे स्थायी रूप में हैं, से प्राप्त किया गया है।
उदाहरण:
C(s)graphite + 2H2(g) → CH4(g) ∆fH°
= - 74.81 kJ mol-1
प्रश्न 9.
किसी गैस के मुक्त प्रसारण को समझाइए।
उत्तर:
गैस का मुक्त प्रसारण - किसी गैस का निर्वात में प्रसारण, मुक्त प्रसारण कहलाता है। आदर्श गैस के मुक्त प्रसारण में कोई कार्य नहीं होता है।
ऊष्मागतिकी के प्रथम नियम से:
∆U = q + w
( w = - Pex ∆V)
w का मान रखने पर
∆U = q - Pex ∆V
स्थिर आयतनी प्रक्रम के लिए ∆V = 0
अतः
∆U = qv
किसी आदर्श गैस का मुक्त एवं समतापीय प्रसारण निर्वात में होता है तो (T = स्थिरांक) तो, w = 0 है, क्योंकि Pex = 0 है। जूल ने प्रयोगों द्वारा ज्ञात किया कि 9 = 0 है, इसलिए ∆U = 0.
प्रश्न 10.
समीकरण ∆U = q + w को समतापीय उत्क्रमणीय तथा अनुत्क्रमणीय प्रक्रमों के लिए किस प्रकार व्यक्त किया जाता है?
उत्तर:
समीकरण (AU = q. + w) को समतापीय उत्क्रमणीय तथा अनुत्क्रमणीय प्रक्रमों के लिए इस प्रकार व्यक्त किया जा सकता है-
(i) समतापीय अनुत्क्रमणीय प्रक्रम के लिए
q = - w = Pex (Vf - Vi )
(ii) समतापीय उत्क्रमणीय प्रक्रम के लिए
q = w = nRT In Vf/Vi = 2.303 nRT log Vf/Vi
(iii) रुद्धोष्म प्रक्रम के लिए, q = 0
∆U = Wad
प्रश्न 11.
कणन एन्थैल्पी या परमाणुकरण की एन्थैल्पी को परिभाषित कीजिए तथा इसका उदाहरण भी बताइए।
उत्तर:
किसी पदार्थ के एक मोल में उपस्थित सभी बन्धों को तोड़कर उसके परमाणुओं में पृथक् करके गैसीय अवस्था में परिवर्तित करने पर हुए एन्थैल्पी परिवर्तन को कणन एन्थैल्पी कहते हैं।
उदाहरण:
(i) H2(g) → 2H(g) ΔH° = 435.05 kJ mol-1
(ii) Na(s) → Na (g) ΔH° = 108.4 kJ mol-1
प्रश्न 12.
विलयन एन्थैल्पी, जालक एन्थैल्पी, विलायकन एन्थैल्पी क्या होती है? सिद्ध कीजिये कि विलयन एन्थैल्पी, जालक एन्थैल्पी तथा विलायकन एन्थैल्पी का योग होती है।
उत्तर:
किसी पदार्थ के एक मोल को स्थिर ताप व दाब पर विलायक की विशिष्ट मात्रा में घोलने पर हुए एन्थैल्पी परिवर्तन को विलयन एन्थैल्पी कहते हैं।
जालक एन्थैल्पी: जब एक मोल ठोस आयनिक यौगिक गैसीय अवस्था में अपने आयनों में वियोजित होता है तो इस प्रक्रिया में हुए ए-थैल्पी परिवर्तन को जालक एन्थैल्पी कहते हैं।
विलायकन एन्थैल्पी: विलेय के आयनों के चारों ओर विलायक के अणुओं के जुड़ने से हुए एन्थैल्पी परिवर्तन को विलायकन एन्थैल्पी कहते हैं।
विलयन एन्थैल्पी, जालक एन्थैल्पी तथा विलायकन एन्थैल्पी में सम्बन्ध को निम्न प्रकार दर्शाया जा सकता है।
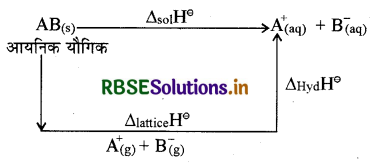
अतः हेस के नियम से ∆sol He = ∆lattice H® + ∆hyaH
अर्थात् विलयन एन्थैल्पी = जलयोजन एन्थैल्पी + विलायकन एन्थैल्पी (जलयोजन एन्थैल्पी)
प्रश्न 13.
आबन्ध वियोजन एन्थैल्पी तथा औसत आबन्ध एन्थैल्पी में क्या अन्तर है? समझाइए।
उत्तर:
आबन्ध वियोजन एन्थैल्पी - किसी गैसीय सहसंयोजक द्विपरमाणुक अणु के एक मोल में उपस्थित सभी बन्धों के टूटकर गैसीय उत्पाद बनने में हुए एन्थैल्पी परिवर्तन को आबन्ध वियोजन एन्थैल्पी कहते हैं।
उदाहरण H2(g) → 2H(g) ∆H-H = 435.0kJ mol-1 H-H ∆H-H = 435.0kJ mol-1
औसत आबन्ध एन्थैल्पी - बहुपरमाणुक अणुओं में उपस्थित समान प्रकार के सभी बन्धों को तोड़ने के लिए आवश्यक कुल ऊर्जा के औसत को, औसत आबन्ध एन्थैल्पी कहते हैं।
जैसे CH4 में C-H बन्ध की औसत बन्ध एन्थैल्पी

प्रश्न 14.
स्वतः प्रवर्तिता क्या होती है? समझाइए।
उत्तर:
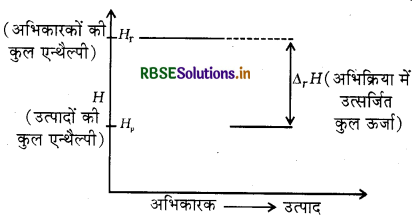
स्वतःप्रवर्तित प्रक्रम जैसे पहाड़ी से जल का गिरना, गैसों का उच्च दाब से निम्न दाब की ओर प्रसारण इत्यादि में प्रक्रम के होने की दिशा में निकाय की स्थितिज ऊर्जा में कमी होती है, अतः एक रासायनिक अभिक्रिया उस दिशा में स्वतःप्रवर्तित होगी, जिस दिशा में ऊर्जा में कमी होगी जैसा कि ऊष्माक्षेपी अभिक्रियाओं में होता है।
उदाहरण:
(i) 1/2H2(g) + 1/2Cl2(g) → HCl(g) ΔrH = - 92.32 KJ mol-1
(ii) H2(g) + 1/2O2(g) → H2O(l); ΔfH = - 285.KJ mol-1
किसी ऊष्माक्षेपी अभिक्रिया में एन्थैल्पी में हुई कमी को निम्न आरेख द्वारा दर्शाया जा सकता है:

प्रश्न 15.
मुक्त ऊर्जा परिवर्तन तथा साम्य स्थिरांक में सम्बन्ध स्थापित कीजिए।
उत्तर:
ऊष्मागतिकी में उत्क्रमणीयता एक विशेष परिस्थिति है जिसमें निकाय हमेशा अपने परिवेश से पूर्णतः साम्य में रहता है। रासायनिक अभिक्रियाओं की उत्क्रमणीय स्थिति में अभिक्रिया दोनों दिशाओं में साथ-साथ चलती है ताकि साम्य स्थापित हो सके।इससे. ज्ञात होता है कि अभिक्रिया दोनों दिशाओं में मुक्त ऊर्जा में कमी के साथ चलती है जो कि असंभव लगता है। यह तभी संभव हो सकता है जब साम्यावस्था पर निकाय की मुक्त ऊर्जा न्यूनतम हो। यदि ऐसा नहीं होता है तो निकाय स्वतः ही न्यूनतम मुक्त ऊर्जा वाली स्थिति में परिवर्तित हो जाएगा अतः कोई अभिक्रिया तभी साम्यावस्था में होगी जब ΔG = 0।
आंकिक प्रश्न (Numerical Questions):
प्रश्न 1.
जब जल के 1 मोल को 1 वायुमण्डलीय दाब व 373 K ताप पर भाप में बदलते हैं तो 40,670 जूल ऊष्मा अवशोषित होती है। इस प्रक्रम में आन्तरिक ऊर्जा में कितना परिवर्तन होगा ? जल तथा भाप के मोलर आयतन क्रमशः 18.0 तथा 30,600 cm3 हैं
उत्तर:
हम जानते हैं कि ∆H = ∆U + P∆V
∆H = 40,670 जूल, P = 1 atm = 101.3 x 10NM-2 ∆V = 30,600 - 18.0 = 30,582 cm3 = 30,582 × 10 m3
अतः आन्तरिक ऊर्जा में परिवर्तन
∆U = ∆H – P∆V
∆U = (40670) - ( 101.3 x 103 x 30582 × 10-6) ∆U = 40670 - 3097.95
∆U = 37572.0 जूल = 30.572 kJ
प्रश्न 2.
स्थिर आयतन एवं 298 K ताप पर मेथेन की विरचन एन्थैल्पी - 73.40kJ है तो इसी ताप पर इस अभिक्रिया की स्थिर दाब पर विरचन एन्थैल्पी ज्ञात कीजिये।
उत्तर:
मेथेन का विरचन निम्न समीकरण के अनुसार होता है:
C(s) + 2H2 ( g ) → CH4 (g)
हम जानते हैं कि ∆H = ∆U + ∆n(g)RT
∆U = -73.40 kJ ∆n(g) = 1 - 2 = -1
R = 8.314 × 10-3 kJ K 1mol-1 T = 298 K
अतः स्थिर दाब पर विरचन एन्थैल्पी -
∆H = 73.40 + (- 1) × 8.314 x 103 x 298
∆H = - 73.40 - 2.47
∆H = 75.87 kJ
प्रश्न 3.
300 K ताप पर 7L के एक सिलिण्डर में 12 मोल ऑक्सीजन गैस भरी हुई है। गैस के रिसाव के कारण यह गैस 2 वायुमण्डलीय दाब तक बाहर निकलती है तो गैस द्वारा किए गए कार्य की गणना कीजिये।
उत्तर:
ऑक्सीजन गैस के मोल मोल
= 12 P = 2 atm.
Vi = 7 L तथा T = 300K, R = 0.082 L atm K-1mol-1
चूँकि गैस आदर्श गैस के समान व्यवहार करती है अतः
pV = nRT
(V2) या V = nRT/P = \(\frac{12 \times 0.082 \times 300}{2}\)
= 147.6 L
कार्य अनुत्क्रमणीय रूप से किया जा रहा है अतः
W = -Pex ∆V
= -2(V2 - V1)
= -2(147.6 - 7)
=- 2 x 140.6
= - 281.2 Latm.
चूँकि 1 L atm. = 101.3 J
अतः w = -281.2 x 101.3 J
w = 28485 J
w = - 28.48 kJ.

प्रश्न 4.
निम्नलिखित अभिक्रिया के लिए ∆H = 1300kJ है तो इसके लिए ∆U का मान ज्ञात कीजिए। (T = 3000K )
C3H6(g) + 4.5O2 (g) → 3CO2 (g) + 3H2O(l)
उत्तर:
हम जानते हैं कि
∆H = ∆U + ∆n (g) RT
या
∆U = ∆H - ∆n(g)RT
अतः
∆H = -1300 kJ ∆n(g) = 3 - (1 + 4.5 ) = - 2.5
R = 8.314 × 10-3 kJ K-1mol-1
T = 300K
∆U = -1300 - (-2.5 x 8.314 x 10-3 x 300 )
∆U = - 1300 + 6.235
∆U = -1293.76 KJ
प्रश्न 5.
3 ग्राम पदार्थ का 298 K ताप पर बम कैलोरीमीटर में दहन किया जाता है तो ताप में 2 डिग्री की वृद्धि प्रेक्षित की जाती है। यदि कैलोरीमीटर तथा जल की ऊष्माधारिता 20.5 KJ K-1 है तो AU की गणना कीजिए। पदार्थ का मोलर द्रव्यमान = 27
उत्तर:
हम जानते हैं कि qv = Cv ∆T
चूँकि दहन ऊष्माक्षेपी अभिक्रिया है अतः यह ऋणात्मक होगी।
∆U = qv = -C∆T
अतः
qv = - 20.5 x 2 = - 41 kJ
पदार्थ का मोलर द्रव्यमान = 27
∴ 3g पदार्थ से उत्पन्न ऊष्मा = 41 kJ
अतः 27 g पदार्थ से उत्पन्न ऊष्मा =
\(\Delta \mathbf{S}_{\text {vap }}=\frac{\Delta H_{v a b}}{T b}\) \(=\frac{39836}{351}\)
∆U = -369 kJ mol-1
∆U = - 3,69 x 102 kJ mol-1
प्रश्न 6.
एक मोल एथेनॉल को उसके क्वथनांक 78°C पर वाष्पीकृत किया जाता है। यदि इसके वाष्पन की गुप्त ऊष्मा 866 जूल प्रति मोल है तो इसमें होने वाले एन्ट्रॉपी परिवर्तन की गणना कीजिए।
उत्तर:
C2H5OH (एथेनॉल) का अणु भार = 46
\(\Delta \mathrm{S}_{\mathrm{vap}}=\frac{\Delta H_{\mathrm{vap}}}{T b}\)
ΔΗναρ
= 866 × 46 जूल प्रति मोल = 39836 J mol-1
T = 273 + 78 = 351 K
अत: \(\Delta \mathbf{S}_{\text {vep }}=\frac{\Delta H_{\text {vab }}}{T b}=\frac{39836}{351}=\)113.49 J K-1
प्रश्न 7.
वह ताप ज्ञात कीजिये जिस पर द्रव जल एवं जल वाष्प साम्यावस्था में होंगे (ΔH vap = 40.73 kJ mol-1, ΔSvap = 109 JK-1 mol-1)
उत्तर:
ΔHvap = 40.73 kJ mol-1 = 40.73 × 1000 J mol-1
= 40730 J mol-1
ΔSvap = 109 JK-1mol-1
\(\Delta \mathrm{S}_{\mathrm{vap}}=\frac{\Delta \mathrm{H}_{\mathrm{vq}}}{\mathrm{T}_{\mathrm{b}}}\)
\(\mathrm{T}_{\mathrm{b}}=\frac{\Delta \mathrm{H}_{\text {vap }}}{\Delta \mathrm{S}_{\text {vap }}}=\frac{40730}{109}\)
= 373.66 K
प्रश्न 8.
0°C पर बर्फ एवं जल साम्यावस्था में है तो ΔH = 6.0kJmol-1 है। बर्फ को जल में परिवर्तित करने के लिए ΔS एवं ΔG का मान ज्ञात कीजिये।
उत्तर:
चूँकि बर्फ तथा जल साम्यावस्था में हैं अत: ΔG = 0 हम जानते हैं कि
ΔG = ΔH - TΔS
0 = ΔH - TΔS
TΔS = ΔH
ΔS = ΔΗ /T
ΔH = 6.0kJ mol-1 = 6000 J mol-1
अतः
\(\Delta S=\frac{6000}{273}\)
21.97 JK-1 mol-1

प्रश्न 9.
अभिक्रिया H2 (g) + I2(s) → 2HI (g) के लिये मानक एन्ट्रॉपी परिवर्तन ज्ञात कीजिये यदि I2 ( s), H2 (g) तथा HI ( g ) की मानक एन्ट्रॉपी क्रमशः 116.7, 130.6 एवं 206.3 JK-1 mol-1 है। यदि इस अभिक्रिया के लिए ΔH° का मान + 51.9kJmol-1 हो तो बताइये कि अभिक्रिया स्वतः होगी या नहीं।
उत्तर:
ΔS° = 2 × S°(HI) – [ S° (H2) + S° (I2)]
= 2 × 206.3 - [130.6 + 116.7]
= 412.6 - 247.3
= 165.3 JK-1 mol-1
ΔH° = 51.9 kJ mol-1
= 51900 J mol-1
तथा मानक अवस्था में
T = 298 K
ΔG° = ΔH° - TΔS °
= 51900 - 298 x 165.3
= 2640.6 J mol-1
चूँकि ΔG° का मान धनात्मक है अतः अभिक्रिया स्वतः नहीं होगी।
प्रश्न 10.
निम्नलिखित अभिक्रिया के लिए मानक मुक्त ऊर्जा परिवर्तन की गणना कीजिये।
C2H2(g) + 2H2(g) → C2H6(g)
C2H(g) तथा C2H6 (g) के लिए
ΔGf का मान क्रमश: 209.2 kJ mol-1 एवं - 32.9 k J mol-1 है।
उत्तर:
ΔG° = ∑ΔGf° (उत्पाद) - ∑ΔGf° (अभिकारक)
= -32.9 kJ mol-1 - (209.2 + 0) kJ mol-1
(चूँकि H2 के लिए ΔG° = 0 होता है।)
= -32.9 - 209.2 kJ mol-1
= -242.1 kJ mol-1
प्रश्न 11.
निम्न आंकड़ों की सहायता से >C = C< की बन्ध ऊर्जा ज्ञात कीजिये:
2C(s) + 2H2(g) = C2H4(g); ΔH = 52.6 kJ .... (1)
C (g) → C (s) ΔH = 716.68kJ .... (2)
H2 (g) = 2H (g); ΔH = 435.84 kJ .... (3)
तथा C-H आबन्ध ऊर्जा = + 413 kJ है।
उत्तर:
सर्वप्रथम C2H4 की परमाणुकरण एन्थैल्पी ज्ञात करेंगे:
C2H4 (g) → 2C (g) + 2H2 (g); ΔH = ?
समी. 2 व 3 को 2 से गुना करके जोड़ने पर
2C(s) + 2H2(g) = 2C(g) + 4H(g);
ΔH = + 2305.04 kJ .... (4)
समीकरण (4) में समीकरण ( 1 ) घटाने पर
C2H4(g) = 2C(g) + 4H(g);
ΔH = 2252.44 kJ .... (5)
अत: C2H4 में उपस्थित एक C = C तथा 4C - H बन्धों को
तोड़ने के लिए आवश्यक ऊष्मा = 2252.44 kJ
अतः 4(C-H) बन्ध ऊर्जा + 1 (C=C) बन्ध ऊर्जा = 2252.44 kJ
4(413 kJ) + C = C बन्ध ऊर्जा = 2252.44 kJ
अत: C = C बन्ध ऊर्जा = 2252.44 kJ - (4 x 413) kJ
= 2252.44 kJ - 1652 kJ
अत: C = C की बन्ध ऊर्जा = 600.44 kJ.
विभिन्न प्रतियोगी परीक्षाओं में पछे गये प्रश्न:
प्रश्न 1.
रुद्धोष्म परिस्थितियों में एक आदर्श गैस के मुक्त प्रसार के लिए निम्न में से कौनसा विकल्प सही है?
(a ) q = 0, ∆T = 0. W = 0
(b) q = 0, ∆T ≠ 0, W ≠ 0
(c) q = 0. ∆T = 0. W = 0
(d) q = 0, ∆T = 0, W ≠ 0
उत्तर:
(c) q = 0. ∆T = 0. W = 0
प्रश्न 2.
निम्न प्रक्रमों पर विचार कीजिए:
|
|
∆H (kJ / mol) |
|
124 → B |
+ 150 |
|
3B → 2C + D |
- 125 |
|
E + A ⇒ 2D |
+ 350 |
B + D → E + 2C के लिए ∆H होगा:
(a) - 325 kJ/mol
(b) 325kJ /mol
(c) 525 kJ/mol
(d) - 175 kJ / mol
उत्तर:
(d) - 175 kJ/mol

प्रश्न 3.
एक आदर्श गैस के नमूने का दाब में परिवर्तन पर होता है। इसकी एन्ट्रॉपी में परिवर्तन होगा:
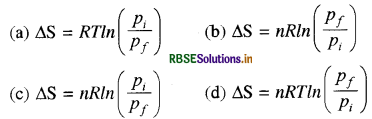
उत्तर:
\(\text { (c) } \Delta \mathrm{S}=n R \ln \left(\frac{p_i}{p_f}\right)\)
प्रश्न 4.
किसी समतापीय प्रक्रम में:
(a) q = 0 एवं ∆E = 0 होता है
(b) q ≠ 0 एवं ∆E = 0 होता है
(c) q = 0 एवं ∆E ≠ 0 होता है
(d) 9 ≠ 0 एवं ∆E ≠ 0 होता है
उत्तर:
(b) q ≠ 0 एवं ∆E = 0 होता है
प्रश्न 5.
298K ताप पर कार्बन मोनोऑक्साइड (CO) को उसके अवयवी तत्वों से बनाने के लिए ∆H - ∆U होगा ( R = 8.314 JK -1 mol-1)
(a ) - 1238.78 J mol-1
(b) 1238.78 J mol-1
(c) - 2477.57 J mol-1
(d) 2477.57 J mol-1
उत्तर:
(b) 1238.78 J mol-1
प्रश्न 6.
स्थिर ताप व दाब पर अभिक्रिया N2(g) + 3H2(g) → 2NH3 (g) के लिए निम्न में से कौनसा व्यंजक सत्य है:
(a) ∆H = ∆U
(b) ∆H = 0
(c) ∆H > ∆U
(d) ∆H < ∆U
उत्तर:
(d) ∆H < ∆U
प्रश्न 7.
ऊष्माक्षेपी अभिक्रियाओं के लिए निम्न में से कौन हमेशा ऋणात्मक होता है?
(a) ∆H
(b) ∆S
(c) ∆G
(d) इनमें से कोई नहीं
उत्तर:
(a) ∆H

प्रश्न 8.
स्वतः प्रक्रम के लिए सही कथन है:
(a) तन्त्र की एण्ट्रॉपी सदैव बढ़ती है
(b) तन्त्र की मुक्त ऊर्जा सदैव बढ़ती है
(c) कुल एण्ट्रॉपी परिवर्तन सदैव ऋणात्मक होता है
(d) कुल एण्ट्रॉपी परिवर्तन सदैव धनात्मक होता है
उत्तर:
(d) कुल एण्ट्रॉपी परिवर्तन सदैव धनात्मक होता है
प्रश्न 9.
एक मोल बर्फ के गलन करने पर होने वाले एण्ट्रॉपी परिवर्तन का मान होगा [ बर्फ का गलनांक = 273 K, बर्फ के लिए गलन की मोलर एन्थैल्पी = 60kJ mol-1 है ]
(a) 11.73 JK-1 mol-1
(b) 18.84 JK-1 mol-1
(c) 219.7 JK-1 mol-1
(d) 24.47 JK-1 mol-1
उत्तर:
(c) 219.7 JK-1 mol-1
प्रश्न 10.
किसी अभिक्रिया के स्वतः होने के लिए सर्वाधिक उचित शर्त है।
(a) अभिक्रिया की सक्रियण ऊर्जा अधिक होनी चाहिए।
(b) अभिक्रिया के दौरान मुक्त ऊर्जा में कमी होनी चाहिए।
(c) उत्पादों की एन्ट्रॉपी अधिक होनी चाहिए।
(d) अभिक्रिया होने पर ऊष्मा उत्सर्जित होनी चाहिए।
उत्तर:
(b) अभिक्रिया के दौरान मुक्त ऊर्जा में कमी होनी चाहिए।
प्रश्न 11.
∆U तथा ∆H में सम्बन्ध है:
(a) ∆U = ∆V + ∆H
(b) ∆H = ∆U + P∆V
(c) ∆H = ∆U - P∆V
(d) ∆U = ∆H + P∆V
उत्तर:
(b) ∆H = ∆U + P∆V
प्रश्न 12.
आंतरिक ऊर्जा होती है:
(a) पूर्णत: स्थितिज
(b) पूर्णत: गतिज
(c) आंशिक गतिज तथा आंशिक स्थितिज
(d) उपर्युक्त में से कोई नहीं
उत्तर:
(c) आंशिक गतिज तथा आंशिक स्थितिज
प्रश्न 13.
298K ताप पर A(e) + B (g) → C(g) अभिक्रिया के लिए ∆E = - 5 कैलोरी और ∆S = - 10 कैलोरी किलो है।
(a) ∆G = + 2612 कैलोरी
(b) ∆G = - 2612 कैलोरी
(c) ∆G = + 261.2 कैलोरी
(d) ∆G = 2379 कैलोरी
उत्तर:
(d) ∆G = 2379 कैलोरी

प्रश्न 14.
सूची I (समीकरणों) को सूची II (प्रकम के प्रकार) से सुमेलित कीजिए और सही चुनाव कीजिए:
|
सूची I समीकरण |
सूची II प्रक्रम का प्रकार |
|
1. Kp > Q |
(i) अस्वतः |
|
2. AG° < RT In Q |
(ii) साम्य |
|
3. Kp = Q |
(iii) स्वतः और ऊष्माशोषी |
|
4. T > ∆H/∆S |
(iv) स्वत: |
(a) 1. (i), 2. (ii), 3. (iii), 4. (iv)
(b) 1. (iii), 2. (iv), 3. (ii), 4. (i)
(c) 1. (iv), 2. (i), 3. (ii), 4. (iii)
(d) 1. (ii), 2. (i), 3. (iv), 4. (iii)
उत्तर:
(c) 1. (iv), 2. (i), 3. (ii), 4. (iii)
प्रश्न 15.
समान ताप और दाब पर दो मोनोएटॉमिक गैसों A तथा B के बराबर आयतन मिलाये जाते हैं। मिश्रण की आपेक्षिक ऊष्मा (Cp/Cv) का अनुपात होगा:
(a) 0.83
(b) 1.50
(c) 3.3
(d) 1.67
उत्तर:
(d) 1.67
प्रश्न 16.
निम्नलिखित व्यंजकों में से कौन असत्य है:
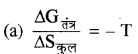
(b) समतापी प्रक्रम में, Wउत्क्रमणीय = - nRT In Vf/Vt
(c) In K = \(\frac{\Delta \mathrm{H}^{\circ}-\mathrm{T} \Delta \mathrm{S}^{\circ}}{\mathrm{RT}}\)
(d) K = e-∆G°/RT
उत्तर:
(d) K = e-∆G°/RT
प्रश्न 17.
वह स्पीशीज जिसकी परिभाषानुसार 298K पर मानक मोलर संभवन एन्थैल्पी शून्य है:
(a) Br2 (g)
(b) Cl2(g)
(c) H2O(g)
(d) CH4 (g)
उत्तर:
(b) Cl2(g)
प्रश्न संख्या 18 एवं 19 दिये गये Passage पर आधारित हैं।
Passage
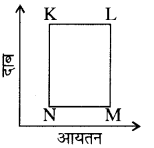
गैस के निश्चित द्रव्यमान 'm' की अवस्था परिवर्तन K से L से M से N तथा वापस K में चित्र द्वारा दिखाई गई है।
प्रश्न 18.
क्रमिक परिचालन जो इन अवस्था परिवर्तनों में सहायक है, वह है:
(a) गर्म, ठण्डा, गर्म, ठण्डा करने पर
(b) ठण्डा, गर्म, ठण्डा, गर्म करने पर
(c) गर्म, ठण्डा, ठण्डा, गर्म करने पर
(d) ठण्डा, गर्म, गर्म, ठण्डा करने पर
उत्तर:
(c) गर्म, ठण्डा, ठण्डा, गर्म करने पर
प्रश्न 19.
अवस्था परिवर्तनों की स्थितियों में समआयतनिक प्रक्रम युग्म है:
(a) K से L और L से M
(b) L से M और N से K
(c) L से M और M से N
(d) M से N और N से K
उत्तर:
(b) L से M और N से K
