RBSE Class 11 Chemistry Important Questions Chapter 1 रसायन विज्ञान की कुछ मूल अवधारणाएँ
Rajasthan Board RBSE Class 11 Chemistry Important Questions Chapter 1 रसायन विज्ञान की कुछ मूल अवधारणाएँ Important Questions and Answers.
Rajasthan Board RBSE Solutions for Class 11 Chemistry in Hindi Medium & English Medium are part of RBSE Solutions for Class 11. Students can also read RBSE Class 11 Chemistry Important Questions for exam preparation. Students can also go through RBSE Class 11 Chemistry Notes to understand and remember the concepts easily.
RBSE Class 11 Chemistry Chapter 1 Important Questions रसायन विज्ञान की कुछ मूल अवधारणाएँ
बहुचयनात्मक प्रश्न (Multiple Choice Questions):
प्रश्न 1.
आधुनिक परमाणु भार किस पर आधारित है?
(अ) 12C
(ब) 16C
(स) 13C
(द) 1H
उत्तर:
(अ) 12C

प्रश्न 2.
मानक ताप एवं दाब पर 2 ग्राम मेथेन का आयतन कितना होगा?
(अ) 2.8 L
(ब) 5.6 L
(स) 11.2 L
(द) 22.4 L
उत्तर:
(अ) 2.8 L
प्रश्न 3.
पूर्वलग्न 1018 है:
(अ) गीगा
(ब) मेगा
(स) एक्सा
(द) हेक्टा
उत्तर:
प्रश्न 4.
मान 10.216 में कितने सार्थक अंक हैं?
(अ) 2
(ब) 3
(स) 4
(द) 5
उत्तर:
(स) 4.
प्रश्न 5.
एक किलोग्राम इलेक्ट्रॉन में इलेक्ट्रॉनों की संख्या कितनी होगी?
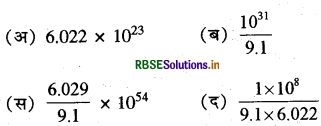
उत्तर:
\(\text { (ब) } \frac{10^{31}}{9.1}\)
प्रश्न 6.
ग्लूकोस अणु का आण्विक द्रव्यमान कितना होता है?
(अ) 342 u
(ब) 180 u
(स) 90u
(द) उपर्युक्त में से कोई नहीं
उत्तर:
(ब) 180 u
प्रश्न 7.
4 g NaOH, 250 mL विलयन में उपस्थित है तो इसकी मोलरता कितनी होगी?
(अ) 0.2M
(ब) 0.4M
(स) 0.8M
(द) 0.1M
उत्तर:
(ब) 0.4M
प्रश्न 8.
निम्नलिखित में से सान्द्रता का कौनसा मात्रक ताप पर निर्भर करता है?
(अ) मोललता
(ब) मोलरता
(स) मोल
(द) द्रव्यमान प्रतिशत
उत्तर:
(ब) मोलरता
प्रश्न 9.
हवा है एक
(अ) यौगिक
(ब) समांगी मिश्रण
(स) विषमांगी मिश्रण
(द) तत्व
उत्तर:
(ब) समांगी मिश्रण
प्रश्न 10.
पदार्थ की मात्रा का SI मात्रक है:
(अ) ग्राम
(ब) मोल
(स) किलोग्राम
(द) मिलीग्राम
उत्तर:
(ब) मोल
प्रश्न 11.
C2H6 के एक मोल में उपस्थित हैं:
(अ) हाइड्रोजन के 6.022 x 1023 परमाणु
(ब) हाइड्रोजन के 6 ग्राम परमाणु
(स) C2Hg के 1.806 x 1023 अणु
(द) कार्बन के 6 ग्राम
उत्तर:
(ब) हाइड्रोजन के 6 ग्राम परमाणु

प्रश्न 12.
निम्नलिखित में से किसमें परमाणुओं की संख्या अधिकतम है?
(अ) CO2 के 6.022 x 1021 अणु
(ब) NIP पर CO2 के 22.4 लीटर
(स) CO2 के 0.44 ग्राम
(द) उपर्युक्त सभी में समान
उत्तर:
(ब) NIP पर CO2 के 22.4 लीटर
प्रश्न 13.
कमरे के ताप पर जल की एक बूँद में (आयतन 0.0018ml) जल के अणुओं की संख्या कितनी होगी?
(अ) 6.022 x 1019
(ब) 4.84 x 1017
(स) 6.022 x 1023
(द) 1.084 x 1018
उत्तर:
(अ) 6.022 x 1019
प्रश्न 14.
निम्नलिखित में से किसका भार न्यूनतम है?
(अ) नाइट्रोजन के 2 ग्राम परमाणु
(ब) कार्बन के 3.011 x 1023 परमाणु
(स) सल्फर का 1 मोल
(द) सिल्वर का 7.0 ग्राम
उत्तर:
(ब) कार्बन के 3.011 x 1023 परमाणु
प्रश्न 15.
मानक ताप व दाब पर किसी आदर्श गैस के 1 ml में अणुओं की संख्या होगी:
(अ) 6.022 x 1023
(ब) 2.69 x 1019
(स) 2.69 x 1023
(द) उपर्युक्त में से कोई नहीं
उत्तर:
(ब) 2.69 x 1019
प्रश्न 16.
जल की मोलर सान्द्रता कितनी होती है?
(अ) 5.55
(ब) 55.5
(स) 0.555
(द) 555
उत्तर:
(ब) 55.5
प्रश्न 17.
MgCl2 में Mg (परमाणु भार 24 ) का तुल्यांकी भार होगा:
(अ) 12
(ब) 24
(स) 6
(द) 18
उत्तर:
(अ) 12
प्रश्न 18.
2 MH2SO4 की नार्मलता है:
(अ) N/2
(ब) N/4
(स) 2N
(द) 4N
उत्तर:
(द) 4N
प्रश्न 19.
मोल अंश की इकाई है:
(अ) मोल/लीटर
(ब) मोल
(स) मोल / ग्राम
(द) इकाई नहीं होती
उत्तर:
(द) इकाई नहीं होती
प्रश्न 20.
किसी तत्व की विशिष्ट ऊष्मा 0.16 है तो इसका परमाणु भार कितना होगा?
(अ) 16
(ब) 32
(स) 40
(द) 20
उत्तर:
(स) 40
प्रश्न 21.
4 मोल A तथा 9 मोल B, निम्नलिखित समीकरण के अनुसार क्रिया करते हैं- A + 2B C, तो C के कितने मोल बनेंगे?
(अ) 10
(ब) 5
(स) 4
(द) 8
उत्तर:
(स) 4
प्रश्न 22
0.142 ग्राम Cl2 में उपस्थित इलेक्ट्रॉनों की संख्या है:
(अ) 4.095 x 1023
(ब) 4.095 x 1024
(स) 4.095 x 1029
(द) 4.095 x 1022
उत्तर:
(द) 4.095 x 1022
रिक्त स्थान वाले प्रश्न (Fill in the blanks):
प्रश्न 1.
लम्बाई का SI मात्रक ..................... है।
उत्तर:
मीटर

प्रश्न 2.
हीरा में उपस्थित तत्व ..................... है।
उत्तर:
कार्बन
प्रश्न 3.
11.72 में कुल सार्थक अंक ..................... है।
उत्तर:
4
प्रश्न 4.
18Ar40 तथा 20 Ca40 आपस में ................ होता है।
उत्तर:
समभारिक
प्रश्न 5.
अणुभार = 2 x ................ होता है।
उत्तर:
वाष्प
प्रश्न 6.
H2SO4 का अणुभार 98 है तो इसका तुल्यांकी भार होगा।
उत्तर:
49
प्रश्न 7.
आवोगाद्रो संख्या का मान ..................... होता है।
उत्तर:
6.022 x 1023
प्रश्न 8.
मोल अंश ................... मात्रक है।
उत्तर:
भार भार
प्रश्न 9.
0.0046 को वैज्ञानिक संकेतन में ..................... लिखा जाता है।
उत्तर:
4.6 x 103
प्रश्न 10.
10 ग्राम हाइड्रोजन में ................... मोल उपस्थित होते हैं।
उत्तर:
5.
निम्नलिखित में से सत्य एवं असत्य कथन छाँटिए (True and False Statement):
प्रश्न 1.
परमाणु द्रव्यमान का आधुनिक आधार 0-16 है।
उत्तर:
असत्य
प्रश्न 2.
वायु एक मिश्रण है।
उत्तर:
सत्य

प्रश्न 3.
1 मोल C6H12O6 में 12 मोल ऑक्सीजन परमाणु होते हैं।
उत्तर:
असत्य
प्रश्न 4.
मोलरता ताप पर निर्भर नहीं करती है।
उत्तर:
असत्य
प्रश्न 5.
तत्व के सभी कण एक ही प्रकार के होते हैं।
उत्तर:
सत्य
प्रश्न 6.
किसी ठोस का गलनांक एक रासायनिक गुण है।
उत्तर:
असत्य
प्रश्न 7.
HCl का तुल्यांकी भार तथा अणुभार समान होता है।
उत्तर:
सत्य
प्रश्न 8.
किसी यौगिक में उपस्थित विभिन्न तत्वों की प्रतिशत मात्रा (भारात्मक) को प्रतिशत संघटन कहते हैं।
उत्तर:
सत्य
प्रश्न 9.
ग्लूकोस अणु का आण्विक द्रव्यमान 3421 होता है।
उत्तर:
असत्य

प्रश्न 10.
किसी पदार्थ में अणुओं की संख्या मोल x आवोगाद्रो संख्या होती है।
उत्तर:
सत्य
मिलान करने वाले प्रश्न (Matching type Questions):
सूची A तथा सूची B का मिलान कीजिए तथा सही कूट
प्रश्न 1.
|
सूची A |
सूची B |
|
(1) ग्राम अणुभार |
(a) गैस का NIP पर आयतन |
|
(2) मोल x 22.4 |
(b) 6.4 |
|
(3) परमाणु भार x विशिष्ट ऊष्मा |
(c) 100 |
|
(4) CaCO3 का मोलर द्रव्यमान |
(d) एक मोल अणुओं का भार |
उत्तर:
|
सूची A |
सूची B |
|
(1) ग्राम अणुभार |
(d) एक मोल अणुओं का भार |
|
(2) मोल x 22.4 |
(a) गैस का NIP पर आयतन |
|
(3) परमाणु भार x विशिष्ट ऊष्मा |
(b) 6.4 |
|
(4) CaCO3 का मोलर द्रव्यमान |
(c) 100 |

प्रश्न 2.
|
सूची A |
सूची B |
|
(1) पदार्थ की मात्रा की इकाई |
(a) भौतिक गुण |
|
(2) कैंसर चिकित्सा |
(b) मोल |
|
(3) 109 |
(c) सिसप्लेटिन |
|
(4) श्यानता |
(d) गीगा |
उत्तर:
|
सूची A |
सूची B |
|
(1) पदार्थ की मात्रा की इकाई |
(b) मोल |
|
(2) कैंसर चिकित्सा |
(c) सिसप्लेटिन |
|
(3) 109 |
(d) गीगा |
|
(4) श्यानता |
(a) भौतिक गुण |
प्रश्न 3.
|
सूची B |
सूची B |
|
(a) वेग प्रति सेकण्ड |
(a) वेग प्रति सेकण्ड |
|
(b) विषमांगी मिश्रण |
(b) विषमांगी मिश्रण |
|
(c) रासायनिक गुणधर्म |
(c) रासायनिक गुणधर्म |
|
(d) तत्व |
(d) तत्व |
उत्तर:
|
सूची A |
सूची B |
|
(1) अम्लता |
(c) रासायनिक गुणधर्म |
|
(2) त्वरण |
(a) वेग प्रति सेकण्ड |
|
(3) लोहे का बुरादा तथा गंधक चूर्ण का मिश्रण |
(b) विषमांगी मिश्रण |
|
(4) हीरा |
(d) तत्व |
प्रश्न 4.
|
सूची A |
सूची B |
|
(1) °C + 273.15 |
(a) समस्थानिक |
|
(2) 0.55ml |
(b) केल्विन (K) |
|
(3) 17C135 तथा 17C137 |
(c) 3.33408 x 102 |
|
(4) 333.408 |
(d) दो सार्थक अंक |
उत्तर:
|
सूची A |
सूची B |
|
(1) °C + 273.15 |
(b) केल्विन (K) |
|
(2) 0.55ml |
(d) दो सार्थक अंक |
|
(3) 17C135 तथा 17C137 |
(a) समस्थानिक |
|
(4) 333.408 |
(c) 3.33408 x 102 |
प्रश्न 5.
|
सूची A |
सूची B |
|
(1) NaCl का मोलर द्रव्यमान |
(a) 2 |
|
(2) 36 ग्राम जल में मोलों की संख्या |
(b) भार आयतन मात्रक |
|
(3) बेन्जीन का मूलानुपाती सूत्र |
(c) 58.5 g mol-1 |
|
(4) नार्मलता |
(d) CH |
उत्तर:
|
सूची A |
सूची B |
|
(1) NaCl का मोलर द्रव्यमान |
(c) 58.5 g mol-1 |
|
(2) 36 ग्राम जल में मोलों की संख्या |
(a) 2 |
|
(3) बेन्जीन का मूलानुपाती सूत्र |
(d) CH |
|
(4) नार्मलता |
(b) भार आयतन मात्रक |

प्रश्न 6.
|
सूची A |
सूची B |
|
(1) 0.0026 में सार्थक अंक |
(a) 40 x 102Pm |
|
(2) 8 ग्राम NaOH प्रति लीटर |
(b) 2 |
|
(3) 40 A |
(c) 0.2M |
|
(4) एथेन में इलेक्ट्रॉनों की संख्या |
(d) 18 |
उत्तर:
|
सूची A |
सूची B |
|
(1) 0.0026 में सार्थक अंक |
(b) 2 |
|
(2) 8 ग्राम NaOH प्रति लीटर |
(c) 0.2M |
|
(3) 40 A |
(a) 40 x 102Pm |
|
(4) एथेन में इलेक्ट्रॉनों की संख्या |
(d) 18 |
प्रश्न 7.
|
सूची A |
सूची B |
|
(1) डेसी |
(a) परमाणु भार |
|
(2) परमाणु का तुल्यांकी भार x संयोजकता |
(b) भारभार मात्रक |
|
(3) 6.022 x 102 कार्बन परमाणु |
(c) 1/10 |
|
(4) मोललता |
(d) 1.2 ग्राम कार्बन |
उत्तर:
|
सूची A |
सूची B |
|
(1) डेसी |
(c) 1/10 |
|
(2) परमाणु का तुल्यांकी भार x संयोजकता |
(a) परमाणु भार |
|
(3) 6.022 x 102 कार्बन परमाणु |
(d) 1.2 ग्राम कार्बन |
|
(4) मोललता |
(b) भारभार मात्रक |
प्रश्न 8.
|
सूची A |
सूची B |
|
(1) 1 कैलोरी |
(a) KCO2 |
|
(2) क्लोरीन का औसत परमाणु द्रव्यमान |
(b) 4.184 जूल |
|
(3) मोल x अणुभार |
(c) 35.5 |
|
(4) पोटेशियम ऑक्सेलेट का मूलानुपाती सूत्र |
(d) ग्राम में मात्रा |
उत्तर:
|
सूची A |
सूची B |
|
(1) 1 कैलोरी |
(b) 4.184 जूल |
|
(2) क्लोरीन का औसत परमाणु द्रव्यमान |
(c) 35.5 |
|
(3) मोल x अणुभार |
(d) ग्राम में मात्रा |
|
(4) पोटेशियम ऑक्सेलेट का मूलानुपाती सूत्र |
(a) KCO2 |
अतिलघूत्तरात्मक प्रश्न (Very Short Answer Type Questions):
प्रश्न 1.
एजिडोथाईमिडिन (AZT) को किस रोग के लिए औषधि के रूप में प्रयुक्त किया जाता है?
उत्तर:
एड्स रोग।
प्रश्न 2.
समांगी मिश्रण किसे कहते हैं?
उत्तर:
वह मिश्रण जिसमें उपस्थित घटक एक-दूसरे में पूर्णतया मिश्रित होते हैं, जैसे - जल में चीनी का विलयन, इसमें पूरे मिश्रण का संघटन समान होता है।
प्रश्न 3.
मिश्रण को पृथक् करने की प्रमुख विधियाँ कौनसी होती हैं?
उत्तर:
क्रिस्टलन तथा आसवन।

प्रश्न 4.
विषमांगी मिश्रण का एक उदाहरण दीजिए।
उत्तर:
दाल के दाने तथा कंकड़ का मिश्रण।
प्रश्न 5.
बल का SI मात्रक क्या होता है?
उत्तर:
बल का SI मात्रक न्यूटन होता है।
प्रश्न 6.
1 amu कितने ग्राम के बराबर होता है?
उत्तर:
1 amu = 1.66056 x 10-24 g
प्रश्न 7.
NaCl का सूत्र द्रव्यमान कितना होगा?
उत्तर:
NaCl का सूत्र द्रव्यमान 23.0u + 35.5u = 58.5 u
प्रश्न 8.
43A को पिकोमीटर में रूपान्तरित कीजिए।
उत्तर:
43 = 43 x 10-10 m
= 43 x 102 Pm (क्योंकि 1 Pm = 10-12 m)
प्रश्न 9.
0.0025 में कितने सार्थक अंक हैं?
उत्तर:
दो ।
प्रश्न 10.
1.0 x 102 में कितने सार्थक अंक हैं?
उत्तर:
दो ।
प्रश्न 11.
0.00623 मीटर को वैज्ञानिक संकेतन में लिखिए।
उत्तर:
6.23 x 10-3 मीटर।
प्रश्न 12.
AlCl3 के एक नमूने में 6 x 10-24 Cl- आयन उपस्थित हैं तो इसमें उपस्थित AlCl3 के सूत्र इकाइयों (Formula Units) की संख्या बताइए।
उत्तर:
AlCl3 के सूत्र के अनुसार AlCI3 की एक सूत्र इकाई में 3 Cl होते हैं अत: 6 x 1024 Cl में AlCl3 की सूत्र इकाइयाँ = 2 x 1024 होंगी।
प्रश्न 13.
मोलरता ज्ञात करने का सूत्र बताइए।
उत्तर:
मोलरता (M) = 
प्रश्न 14.
मोललता पर ताप का कोई प्रभाव नहीं होता, क्यों?
उत्तर:
मोललता द्रव्यमान से सम्बन्धित है तथा द्रव्यमान पर ताप का कोई प्रभाव नहीं होता अतः मोललता पर भी ताप का कोई प्रभाव नहीं होता।
प्रश्न 15.
17 ग्राम अमोनिया का NTP पर आयतन बताइए।
उत्तर:
17g NH3 = 0.5 मोल = NTP पर आयतन क्योंकि NIP पर किसी गैस के एक मोल का आयतन 22.4 लीटर
प्रश्न 16.
20 ग्राम हाइड्रोजन में इसके कितने ग्राम मोल उपस्थित हैं?
उत्तर:
ग्राम मोल = 20/2 = 10 ग्राम मोल।

प्रश्न 17.
0.2 मोल C6H12O6 में हाइड्रोजन परमाणुओं की संख्या बताइए।
उत्तर:
1 मोल C6H12O6 में H परमाणु 6.022 x 1023 x 12 अतः 0.2 मोल C6H12O6 में H परमाणु - 0.2 x 6.022 x 1023 × 12 = 14.4528 x 1023
लघुत्तरात्मक प्रश्न (Short Answer Type Questions ):
प्रश्न 1.
पदार्थों के भौतिक तथा रासायनिक गुणधर्म क्या होते हैं?
उत्तर:
भौतिक गुणधर्म वे गुणधर्म जिन्हें पदार्थ की पहचान या संघटन में परिवर्तन किए बिना मापा जा सकता है उन्हें भौतिक गुण कहते हैं। जैसे- रंग, गंध, गलनांक, क्वथनांक, घनत्व इत्यादि। रासायनिक गुणधर्म वे गुणधर्म जिनके मापन में रासायनिक परिवर्तन होता है, उन्हें रासायनिक गुणधर्म कहते हैं। जैसे - अम्लता, क्षारकता, दहन इत्यादि।
प्रश्न 2.
मात्रात्मक गुणधर्म क्या होते हैं?
उत्तर:
मात्रात्मक गुणधर्म वे गुण हैं जिनसे पदार्थ की मात्रा ज्ञात होती है। इनमें पहले संख्या तथा उसके बाद इकाई लिखी जाती है।
उदाहरण: लम्बाई, क्षेत्रफल, आयतन इत्यादि। जैसे - 6m = 6 मीटर।
प्रश्न 3.
निम्नलिखित पदार्थों को तत्त्व, यौगिक तथा मिश्रण में वर्गीकृत कीजिए:
वायु, मर्करी, ऑक्सीजन, ग्लूकोस, साधारण नमक, मार्बल, ताँबा, पोटेशियम, सीमेन्ट।
उत्तर:
- तत्त्व- मर्करी, ऑक्सीजन, ताँबा तथा पोटेशियम।
- यौगिक- ग्लूकोस, साधारण नमक तथा मार्बल।
- मिश्रण - वायु तथा सीमेन्ट।
प्रश्न 4.
द्रव्यमान तथा भार में अन्तर बताइए।
उत्तर:
किसी पदार्थ का द्रव्यमान उसमें स्थित द्रव्य की मात्रा होती है जबकि किसी वस्तु का भार उस पर लगने वाला गुरुत्वीय बल होता है। किसी पदार्थ का द्रव्यमान निश्चित होता है जबकि उसका भार भिन्न-भिन्न स्थलों पर भिन्न-भिन्न हो सकता है।
प्रश्न 5.
मोल को परिभाषित कीजिए।
उत्तर:
किसी निकाय में पदार्थ की वह मात्रा एक मोल के बराबर होती है, जिसमें कणों की संख्या उतनी ही होती है, जितनी 0.012 kg 2 में उपस्थित परमाणुओं की संख्या होती है।

प्रश्न 6.
परमाणु द्रव्यमान का आधुनिक आधार क्या है? समझाइए।
उत्तर:
आजकल परमाणु द्रव्यमान C-12 मानक के आधार पर ज्ञात किया जाता है। इसके अनुसार किसी तत्त्व का परमाणु भार वह संख्या है जिससे यह ज्ञात होता है कि उसका एक परमाणु, C-12 परमाणु के 1/12 वें भाग से कितना गुना भारी है। अतः एक परमाणु
द्रव्यमान मात्रक (amu) = C-12 के द्रव्यमान का 1/12 वाँ भाग
1 amu = 1.66056 x 10-24 g
प्रश्न 7.
6.488 g लैड (Ph) की क्रिया 1.002 g 'ऑक्सीजन से कराने पर PbO2 बनता है। इसे Pb (NO3) को गर्म करके भी बनाया जा सकता है जिसमें ऑक्सीजन की प्रतिशत मात्रा 13.38% है। सिद्ध कीजिये कि ये आँकड़े स्थिर अनुपात के नियम की पुष्टि करते हैं।
उत्तर:
PbO2 का द्रव्यमान 6.488g + 1.002 g = 7.490g
7.49g PbO2 में O2 की मात्रा = 1.002 g
अत: 100g PbO2 में O2 की मात्रा = \(\frac{1.002}{7.49} \times 100\)
= 13.377% = 13.38%
Pb (NO3)2 से प्राप्त PbO2 में ऑक्सीजन की % मात्रा = 13.38% अतः Pb तथा O2 की क्रिया एवं Pb(NO3)2 को गर्म करने से प्राप्त PbO2 में ऑक्सीजन की % मात्रा समान है, इससे स्थिर अनुपात के नियम की पुष्टि होती है।
प्रश्न 8.
सार्थक अंक क्या होते हैं? समझाइये|
उत्तर:
किसी मापन के शुद्ध रूप से प्राप्त परिणाम में अर्थपूर्ण अंकों की संख्या को सार्थक अंक कहते हैं। अतः किसी मापन में सार्थक अंक उन अंकों की संख्या होती है जो निश्चितता के साथ ज्ञात हो तथा उनके साथ एक अनिश्चित अंक हो। उदाहरण- 11.2ml में अंक 11 निश्चित तथा अंक 2 अनिश्चित है तथा अन्तिम अंक में +1 की अनिश्चितता है अतः 11.2ml में 3 सार्थक अंक हैं।
प्रश्न 9.
(a) निम्नलिखित में सार्थक अंकों की संख्या बताइए:
(i) प्रोटॉन का द्रव्यमान 1.672 x 1024g
(ii) इलेक्ट्रॉन का द्रव्यमान = 9.108 x 1028 g
(b) निम्नलिखित को वैज्ञानिक संकेतन में व्यक्त कीजिए:
(i) 7007
(ii) 738.5
उत्तर:
(a) (i) प्रोटॉन का द्रव्यमान = 1.672 x 10-24g में सार्थक अंकों की संख्या = 4
(ii) इलेक्ट्रॉन का द्रव्यमान = 9.108 x 1028g में सार्थक अंकों की संख्या = 4
(b) (i) 7007 = 7.007 x 103
(ii) 738.5 = 7.385 x 102
प्रश्न 10.
निम्नलिखित मानों को चार सार्थक अंकों के रूप में व्यक्त कीजिए:
(i) 5000
(ii) 4.65373
(iii) 50.3625
उत्तर:
(i) 5000 x 10
(ii) 4.654
(iii) 50.36
प्रश्न 11.
मोल अंश किसे कहते हैं? इसे किस प्रकार ज्ञात किया जाता है?
उत्तर:
किसी मिश्रण या विलयन में किसी घटक का मोल अंश, उस घटक के मोलों की संख्या तथा मिश्रण के कुल मोलों का अनुपात होता है। यदि विलेय A, विलायक B में घुला है जिनके मोल क्रमशः तथा nA हैं तो nB हैं तो
A का (XA) मोल अंश = 
\(\mathbf{X}_{\mathrm{A}}=\frac{\mathrm{n}_{\mathrm{A}}}{\mathrm{n}_{\mathrm{A}}+\mathrm{n}_{\mathrm{B}}}\)
B का (XB) मोल अंश = 
\(\mathbf{X}_{\mathrm{B}}=\frac{\mathbf{n}_{\mathrm{B}}}{\mathbf{n}_{\mathrm{A}}+\mathbf{n}_{\mathrm{B}}}\)
किसी मिश्रण के सभी घटकों के मोल अंशों का योग हमेशा इकाई होता है।
XA + XB = 1
प्रश्न 12.
मोलरता किसे कहते हैं? समझाइए।
उत्तर:
मोलरता M: एक लीटर विलयन में घुले हुए विलेय के मोलों की संख्या को विलयन की मोलरता कहते हैं।

प्रश्न 13.
परिशुद्धता तथा यथार्थता किसे कहते हैं? उदाहरण सहित समझाइए।
उत्तर:
प्रत्येक प्रायोगिक मापन में कुछ अनिश्चितता होती है। लेकिन प्रायोगिक मापन के परिणाम परिशुद्ध तथा यथार्थपरक होने आवश्यक हैं।
- परिशुद्धता: किसी भी राशि के विभिन्न मापनों की समीपता को ही परिशुद्धता कहते हैं।
- यथार्थता: किसी विशिष्ट प्रायोगिक मान की, वास्तविक मान से समानता को उसकी यथार्थता कहते हैं।
उदाहरण: यदि किसी परिणाम का सही मान 2.00g है तथा इसके लिए विद्यार्थी A के मापन के दो परिणाम 1.95 g तथा 1.93 g हैं तो ये मान एक-दूसरे के पास होने से परिशुद्ध तो हैं परन्तु यथार्थ नहीं हैं क्योंकि ये मान वास्तविक मान से भिन्न हैं। विद्यार्थी B के मापन के दो परिणाम 1.94 g तथा 2.05 g हैं, जो कि न तो परिशुद्ध हैं और न ही यथार्थपरक विद्यार्थी C के मापन के दो परिणाम 2.01 g तथा 1.99 g हैं जो कि परिशुद्ध भी हैं तथा यथार्थ भी।
प्रश्न 14.
सीमान्त अभिकर्मक क्या होता है? व्याख्या कीजिए।
उत्तर:
किसी अभिक्रिया के संतुलित समीकरण के अनुसार आवश्यक अभिकर्मकों में एक अभिकर्मक आवश्यक मात्रा से कम मात्रा में उपस्थित होता है तथा उसके समाप्त होते ही अभिक्रिया रुक जाती है, उसे सीमान्त अभिकर्मक कहते हैं। उदाहरण- वायु की उपस्थिति में मेथेन का दहन कराने पर मेथेन हमेशा सीमान्त अभिकारक होगी क्योंकि वायु में उपस्थित ऑक्सीजन तो हमेशा आधिक्य में उपस्थित होती है।
प्रश्न 15.
नार्मलता तथा फॉर्मलता किसे कहते हैं? समझाइए। क्या ये ताप पर निर्भर करते हैं?
उत्तर:
नार्मलता - (N) विलेय के ग्राम तुल्यांकों की संख्या, जो एक लीटर विलयन में घुली होती है, उसे विलयन की नार्मलता कहते हैं।

फॉर्मलता (F): एक लीटर विलयन में घुले हुए विलेय के ग्राम सूत्र भारों की संख्या को विलयन की फॉर्मलता कहते हैं। विलेय का विलयन में संगुणन या वियोजन होने पर फॉर्मलता का प्रयोग किया जाता हैं।

नार्मलता तथा फॉर्मलता ताप पर निर्भर करते हैं।
आंकिक प्रश्न (Numerical Questions):
प्रश्न 1.
कार्बन, ऑक्सीजन के साथ क्रिया करके दो प्रकार के ऑक्साइड बनाता है जिनमें कार्बन की प्रतिशत मात्रा क्रमशः 27.27% तथा 42.8% है। सिद्ध कीजिए कि ये आँकड़े गुणित अनुपात के नियम की पुष्टि करते हैं।
उत्तर:
कार्बन के ऑक्साइडों में कार्बन तथा ऑक्सीजन की प्रतिशत मात्राएँ निम्न प्रकार हैं:
|
|
I ऑक्साइड |
II ऑक्साइड |
|
कार्बन |
27.27% |
72.73% |
|
ऑक्सीजन |
42.8% |
57.2% |
I ऑक्साइड में: 72.73 8 ऑक्सीजन से क्रिया करने वाले
कार्बन की मात्रा = 27.27 g
अतः 1 ग्राम ऑक्सीजन से क्रिया करने वाले कार्बन की मात्रा
\(=\frac{27.27}{72.73}\)
= 0.374 g
II ऑक्साइड में - 57.28 ऑक्सीजन से क्रिया करने वाले
कार्बन की मात्रा = 42.88 g
अतः 1 ग्राम ऑक्सीजन से क्रिया करने वाले कार्बन की मात्रा
\(=\frac{42.8}{57.2}\)
= 0.748 g
उपरोक्त दोनों ऑक्साइडों में ऑक्सीजन की एक निश्चित मात्रा (1 ग्राम) से क्रिया करने वाली कार्बन की मात्राएँ क्रमश: 0.374 g तथा 0.748g हैं जो कि एक सरल अनुपात (12) में हैं अतः इससे गुणित अनुपात के नियम की पुष्टि होती है।

प्रश्न 2.
कॉपर का औसत परमाणु द्रव्यमान 63.5 है। इसके दो समस्थानिक 63Cu तथा 65Cu है तो इन समस्थानिकों की % मात्रा की गणना कीजिए।
उत्तर:
माना 63Cu समस्थानिक की प्रतिशत मात्रा = x
तो 65 Cu की प्रतिशत मात्रा = 100 - x
Cu का औसत परमाणु द्रव्यमान =
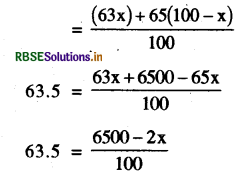
6350 = 6500 - 2x
2x = 6500 - 6350
x = 150/2
= 75
अतः 63Cu की प्रतिशत मात्रा = 75%
तथा 65Cu की प्रतिशत मात्रा = 25%
प्रश्न 3.
ब्रोमीन के दो समस्थानिक 79Br तथा 81Br होते हैं जिनकी प्रतिशत मात्रा क्रमशः 49.7 तथा 50.3 है तो ब्रोमीन का औसत परमाणु द्रव्यमान ज्ञात कीजिए।
उत्तर:
समस्थानिक 79Br की % मात्रा = 49.7
तथा समस्थानिक 81Br की % मात्रा = 50.3
अतः ब्रोमीन का औसत परमाणु द्रव्यमान

= 80.006 amu या u
प्रश्न 4.
3 मोल Al2(SO4)3 में आयनों की संख्या बताइए।
उत्तर:
Al2(SO4)3 के आयनन से कुल 5 आयन (2Al3 + तथा 3SO2) प्राप्त होते हैं।
1 मोल Al2(SO4)3 = 6.022 x 1023
3 मोल Al2(SO4)3 = 3 x 6.022 x 1023
अतः आयनों की संख्या = 5 x 3 x 6.022 x 1023
= 9.033 x 1024
प्रश्न 5.
द्रव मर्करी का घनत्व 13.6 ग्राम सेमी है तो 1 लीटर मर्करी में मोलों की संख्या बताइए। (मर्करी का परमाणु द्रव्यमान = 200)
उत्तर:
द्रव्यमान - घनत्व x आयतन
अतः 1 लीटर (1000 ml) मर्करी का द्रव्यमान =
13.6g cm-3 x 1000 ml gcm = 13600 g
अतः Hg के मोलों की संख्या = 
\(=\frac{13600}{200}\)
= 68 मोल
प्रश्न 6.
3.0g एथेन में उपस्थित इलेक्ट्रॉनों की संख्या बताइए।
उत्तर:
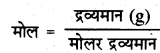
एथेन (C2H6) का मोलर द्रव्यमान 24 + 6 = 30
एथेन के मोल = \(\frac{3.0}{30}\)
अतः एथेन के अणुओं की संख्या = मोलों की संख्या x NA
= 0.1 x 6.022 x 1023
चूँकि एथेन (C2H6) के एक अणु में इलेक्ट्रॉनों की संख्या
= 12 + 6 = 18
अतः एथेन में इलेक्ट्रॉनों की संख्या = अणुओं की संख्या x एक अणु में इलेक्ट्रॉनों की संख्या
= 0.1 x 6.022 x 1023 x 18 = 1.083 × 1024
प्रश्न 7.
जल के एक अणु का आयतन ज्ञात कीजिए। जल का
घनत्व = 1g ml-1
उत्तर:
जल का मोलर द्रव्यमान = 18g
जल के एक अणु का द्रव्यमान = 
अतः आयतन = 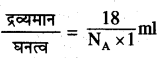
\(=\frac{18}{6.022 \times 10^{23} \times 1}\)
= 2.989 × 10-23ml
= 2.99 × 10-23ml

प्रश्न 8.
एक यौगिक में 40% कार्बन, 6.67% हाइड्रोजन तथा शेष ऑक्सीजन है। यौगिक का आण्विक द्रव्यमान 180 g है तो इसका अणु सूत्र ज्ञात कीजिए।
उत्तर:
ऑक्सीजन की % मात्रा = 100 (40 + 6.67) = 53.33
|
तत्व |
प्रतीक |
तत्व का % |
परमाणु द्रव्यमान |
आपेक्षिक संख्या = प्रतिशत/ परमाणु द्रव्यमान |
सरलतम परमाणु अनुपात |
|
कार्बन |
C |
40 |
12 |
\(\frac{40}{12}=3.33\) |
\(\frac{3.33}{3.33}=1\) |
|
हाइड्रोजन |
H |
6.67 |
1 |
\(\frac{6.67}{1}=6.67\) |
\(\frac{6.67}{3.33}=2\) |
|
ऑक्सीजन |
O |
53.33 |
16 |
\(\frac{53.33}{16}=3.33\) |
\(\frac{3.33}{3.33}=1\) |
यौगिक में तत्त्वों का सरलतम अनुपात
अतः यौगिक का मूलानुपाती सूत्र = CH2O
मूलानुपाती सूत्र द्रव्यमान = 12+ 2 + 16 = 30 g
यौगिक का मोलर द्रव्यमान = 180

\(=\frac{180}{30}\)
अतः यौगिक का आण्विक सूत्र = (CH2O) x 6
= C6H12O6
प्रश्न 9.
6.53 ग्राम Zn को तनु H2SO4 के आधिक्य के साथ गर्म करने पर मुक्त हाइड्रोजन की मात्रा ज्ञात कीजिए।
उत्तर:
Zn तथा H2SO4 की अभिक्रिया निम्न प्रकार होती है:

संतुलित समीकरण के अनुसार
65.3g Zn से प्राप्त हाइड्रोजन = 2g
अतः 6.53 g Zn से प्राप्त हाइड्रोजन = 0.2g
प्रश्न 10.
10.0 ग्राम शुद्ध CaCO3 को गर्म करने पर प्राप्त CO2 गैस का NTP (मानक ताप व दाब) पर आयतन ज्ञात कीजिए।
उत्तर:
CaCO3 का मोलर द्रव्यमान 40 + 12 48 = 100g
CaCO3 के मोल = 
संतुलित समीकरण के अनुसार 1 मोल (100g) CaCO3 के विघटन से प्राप्त CO2 = 1 मोल
अतः 0.1 मोल CaCO3 के विघटन से प्राप्त CO2 = 0.1 मोल
NTP पर किसी गैस के 1 मोल का आयतन 22.4L
0.1 मोल CO2 गैस का NTP पर आयतन = 0.1 x 22.4L
= 2.24 L = 2240ml
प्रश्न 11.
0.1 मोल पोटेशियम क्लोरेट को गर्म करने पर प्राप्त ऑक्सीजन गैस का NTP पर आयतन ज्ञात कीजिए।
उत्तर:
अभिक्रिया का समीकरण
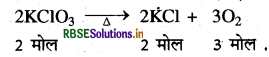
संतुलित समीकरण के अनुसार:
2 मोल KClO3 के विघटन से प्राप्त O2 का NTP पर आयतन = 3 x 22.4 = 67.2 L.
अतः 0.1 मोल KClO3 के विघटन से प्राप्त O2 का NIP पर
आयतन = \(\frac{67.2}{2} \times 0.1\)
= 3.36L
प्रश्न 12.
200 kg, 85% शुद्ध चूना पत्थर को गर्म करने पर कितना कैल्सियम ऑक्साइड प्राप्त होगा?
उत्तर:
चूना पत्थर 85% शुद्ध है अतः 100 kg चूना पत्थर
(CaCO3) में उपस्थित शुद्ध पदार्थ = 85 g
200 kg चूना पत्थर में उपस्थित शुद्ध पदार्थ = \(\frac{85}{100}\) x 200
= 170 kg
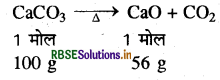
(CaCO3 का मोलर द्रव्यमान
1 मोल
1 मोल
= 40+ 12 + 48 = 100)
(CaO का मोलर द्रव्यमान = 40 + 16 = 56)
संतुलित समीकरण के अनुसार:
100 g CaCO3 से प्राप्त CaO = 56g
या 100 kg CaCO3 से प्राप्त CaO = 56 kg
अत: 170 kg CaCO3 से प्राप्त CaO = \(\frac{56}{100} \times 170\)
= 95.2kg
प्रश्न 13.
500ml एथाइन (C2H2) के पूर्ण दहन से प्राप्त CO2 के NTP पर आयतन की गणना कीजिए।
उत्तर:
एथाइन के दहन का संतुलित समीकरण निम्नलिखित है:

उपरोक्त समीकरण के अनुसार 2 आयतन एथाइन के दहन से 4 आयतन CO2 प्राप्त होती है। अतः 500 ml C2H2 के दहन से प्राप्त CO2 का आयतन = 1000ml
प्रश्न 14.
जल के वैद्युत अपघटन से प्राप्त गैसों का NTP पर कुल आयतन 16.8 लीटर है तो वैद्युत अपघटित जल के भार की गणना कीजिए।
उत्तर:
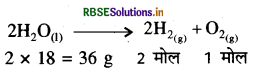
संतुलित समीकरण के अनुसार 36g जल के वैद्युत विघटन से 2
मोल H2 तथा 1 मोल O2 प्राप्त होती है। दोनों गैसों का NTP पर
आयतन = 3 x 22.4 लीटर = 67.2 लीटर
∴ 67.2 लीटर गैस प्राप्त होती है 36 g जल से
16.8 लीटर गैस प्राप्त होगी: x 16.8 = 9 ग्राम जल से
= 67.2
प्रश्न 15
250 मिली विलयन में 12.6 ग्राम क्रिस्टलीय ऑक्सलिक अम्ल घुला हुआ है तथा इस विलयन को घनत्व 1.1 ग्राम प्रति मिली है तो निम्नलिखित की गणना कीजिए:
(a) मोलरता (b) नार्मलता (c) मोललता।
उत्तर:
(a) क्रिस्टलीय ऑक्सेलिक अम्ल
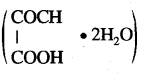
का अणुभार = 126
अतः मोलरता (M) =

(b) क्रिस्टलीय ऑक्सेलिक अम्ल का तुल्यांकी भार
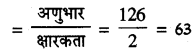
अतः नार्मलता (N) =

(c) विलयन का भार = घनत्व x आयतन
= 1.1 x 250 = 275 g
विलायक का भार = 275 - 12.6 = 262.4 g
अतः मोललता (m)

प्रश्न 16.
214.2 g जलीय विलयन में 34.2 g शर्करा उपस्थित है तो शर्करा की मोल भिन्न ज्ञात कीजिए।
उत्तर:

शर्करा (C12H22O11) का अणुभार = 342
विलायक (जल) का भार = 214.2 - 34.28
= 180
जल के मोल = 180/18 = 10 (ng)

प्रश्न 17.
30g KCl को 300 g जल में घोलकर एक विलयन बनाया गया है। इस विलयन का द्रव्यमान % ज्ञात कीजिए।
उत्तर:
द्रव्यमान प्रतिशत = 
\(=\frac{30}{30+300} \times 100\)
= 9.09%
प्रश्न 18.
एक मिश्रण में 27g जल (H2O), 69gC2H5OH तथा 32 g CH3OH उपस्थित है तो प्रत्येक यौगिक का मोल अंश ज्ञात कीजिए। (जल, C2H5OH तथा CH3OH के अणुभार क्रमशः 18, 46 तथा 32 हैं)
उत्तर:
H2O के मोल = \(\frac{27}{18}=1.5\)
C2H5OH के मोल = \(\frac{69}{46}=1.5\)
CH3OH के मोल = 32/32 = 1
कुल मोल = 1.5 + 1.5 + 1 = 4
जल का मोल अंश (XH2O) = 
C2H5OH का मोल अंश (XC2H5OH) = \(\frac{1.5}{4}=0.375\)
CHOH का मोल अंश (XCHOH) = \(\frac{1}{4}=0.25\)
प्रश्न 19.
22.4 ग्राम C6H5COOH (बेन्जोइक अम्ल) को बेन्जीन में घोलकर एक लीटर विलयन बनाया गया है तो इस विलयन की फॉर्मलता ज्ञात कीजिए।
उत्तर:
C6H5COOH का अणुभार = 122
C6H5COOH का सूत्र भार = 2 x 122 = 224
बेन्जोइक अम्ल, बेन्जीन में द्विलक [(C6H5COOH)2] के रूप में पाया जाता है।
अतः फार्मलता (F) =

प्रश्न 20.
20% (W/w) एथिलीन ग्लाइकॉल (C2HgO2) के मोल अंश की गणना कीजिए। (C2H6O2 का अणुभार = 62 )
उत्तर:
20% (W/W) का अर्थ है = 20g
C2H6O2, 100 g विलयन में उपस्थित है
अतः विलेय का भार = 20 g
विलायक (जल) का भार = 100 - 20 = 80 g
जल के मोल = 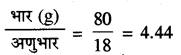
C2H6O2 के मोल = 20/62 = 0.322
C2H6O2 का मोल अंश = 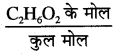
\(=\frac{0.322}{4.44+0.322}=\frac{0.322}{4.762}\)
= 0.0676
विभिन्न प्रतियोगी परीक्षाओं में पछे गये प्रश्न:
प्रश्न 1.
72 kg जल के वियोजन से उत्पन्न ऑक्सीजन का द्रव्यमान है:
(a) 46 kg
(b) 50kg
(c) 64 kg
(d) 72 kg
उत्तर:
(c) 64 kg
प्रश्न 2.
4.25 ग्राम NH3 में कुल परमाणुओं की संख्या है:
(a) 1 x 1023
(b) 2 x 1023
(c) 4 x 1023
(d) 6 x 1023
उत्तर:
(d) 6 x 1023
प्रश्न 3.
9.85 ग्राम BaCO3 के पूर्ण विघटित होने पर उत्पन्न CO2 का STP पर आयतन होगा (Ba = 137)
(a) 0.84 लीटर
(b) 2.24 लीटर
(c) 4.06 लीटर
(d) 1.12 लीटर
उत्तर:
(d) 1.12 लीटर
प्रश्न 4.
एक तत्व X के निम्न समस्थानिक संघटन हैं:
200X : 90%, 199X 8.0% 302X 2.0%
प्राकृतिक तत्व X का मापित औसत परमाणु भार इसके करीब है:
(a) 200 amu
(b) 201 amu
(c) 202 amu
(d) 199 amu
उत्तर:
(c) 202 amu
प्रश्न 5.
किसी धातु के 3.6 ग्राम ऑक्साइड का हाइड्रोजन के साथ अपचयन कराने पर 3.2 ग्राम धातु बचती है। यदि धातु का वाष्प घनत्व 32 हो तो ऑक्साइड का सरलतम सूत्र होगा:
(a) MO
(b) M2O3
(c) M2O
(d) M2O5
उत्तर:
(c) M2O
प्रश्न 6.
यदि H3PO3 का अणुभार M है, तो इसका तुल्यांकी भार होगा:
(a) M
(b) M/2
(c) M/3
(d) 2M
उत्तर:
(b) M/2
प्रश्न 7.
निम्न में amu का मान है:
(a) 1.57 × 10-24 kg
(b) 1.66 x 1024 kg
(c) 1.99 × 10-23 kg
(d) 1.66 x 10-27 kg
उत्तर:
(d) 1.66 x 10-27 kg
प्रश्न 8.
यदि हम कार्बन परमाणु का आपेक्षिक परमाणु भार इकाई के का भार होगा भार 1/12 के स्थान पर 1/6 रूप में लें तो पदार्थ के 1 मोल का भार होगा:
(a) दोगुना घटेगा
(b) दोगुना बढ़ेगा
(c) अपरिवर्तित रहेगा
(d) पदार्थ के अणुभार का फलन है
उत्तर:
(b) दोगुना बढ़ेगा

प्रश्न 9.
यदि एवोगेद्रो संख्या NA को 6.022 x 1023 mol-1 से परिवर्तित कर 6.022 x 1020 mol -1 कर दिया जाए, तो यह परिवर्तित हो जायेगा:
(a) ग्राम की इकाइयों में द्रव्यमान की परिभाषा
(b) एक मोल कार्बन का द्रव्यमान
(c) संतुलित समीकरण में रासायनिक प्रजातियों का एक-दूसरे के प्रति अनुपात
(d) एक यौगिक में तत्वों का एक-दूसरे के प्रति अनुपात
उत्तर:
(b) एक मोल कार्बन का द्रव्यमान
प्रश्न 10.
निम्न में किसमें अणुओं की संख्या अधिकतम है?
(a) 8gH2
(b) 64gSO2
(c) 44g CO2
(d) 48g O3
उत्तर:
(a) 8gH2
प्रश्न 11.
जब 22.4 लीटर H2 (g) को 11.2 लीटर Cl2(g) के साथ STP पर मिश्रित किया जाता है तो HCl(g) के मोल बनेंगे:
(a) 05 मोल HCl(g)
(b) 1.5 मोल HCl (g)
(c) 1 मोल HCl ( g )
(d) 2 मोल HCl (g)
उत्तर:
(c) 1 मोल HCl ( g )
प्रश्न 12.
मोलरता को व्यक्त करते हैं:
(a) ग्राम/लीटर में
(b) मोल / लीटर में
(c) लीटर/मोल में
(d) मोल / 1000 ग्राम में
उत्तर:
(b) मोल / लीटर में
प्रश्न 13.
1 मोलल जलीय विलयन में विलेय का मोल प्रभाव है:
(a) 0.027
(b) 0.036
(c) 0.018
(d) 0.009
उत्तर:
(c) 0.018
प्रश्न 14.
CaCO के 1000 ग्राम जलीय विलयन में 10 ग्राम कार्बोनेट उपस्थित है तो विलयन की
(a) 10 ppm
(b) 100ppm
(c) 1000 ppm
(d) 10000 ppm
उत्तर:
(d) 10000 ppm

प्रश्न 15.
10N HCI के 20 ml को 10 ml 36N H2SO4 से मिलाया लीटर बनाया जाता है। मिश्रण की जाता है और मिश्रण एक नार्मलता होगी:
(a) 0.56 N
(b) 0.50 N
(c) 0.40 N
(d) 0.35 N
उत्तर:
(a) 0.56 N
प्रश्न 16.
10% ग्लूकोज के विलयन को बनाने के लिए 1 लीटर विलयन में ग्लूकोज की कितनी मात्रा घोली जायेगी?
(a) 100 ग्राम
(b) 180 ग्राम
(c) 18 ग्राम
(d) 1.8 ग्राम
उत्तर:
(a) 100 ग्राम
प्रश्न 17.
H2SO4 की मोलरता 18M है और इसका घनत्व 1.8g/ml है अतः इसकी मोललता होगी:
(a) 36
(b) 200
(c) 500
(d) 18
उत्तर:
(c) 500
प्रश्न 18.
3M सोडियम थायोसल्फेट (Na2S2O3) विलयन का घनत्व थायोसल्फेट के भार द्वारा प्रतिशतता 1.25g/mL है। सोडियम की गणना कीजिए:
(a) 12.64%
(b) 37.92%
(c) 0.87%
(d) 63.21%
उत्तर:
(b) 37.92%
प्रश्न 19.
90% H2SO4 विलयन की मोललता होगी:
[ घनत्व = 1.8 ग्राम / मि.ली.]
(a) 1.8
(b) 48.4
(c) 91.83
(d) 94.6
उत्तर:
(c) 91.83

प्रश्न 20.
1 ग्राम कार्बोनेट (M2CO3) की क्रिया HCI की अधिकता में कराने से 0.01186 मोल CO2 उत्पन्न होती है। M2CO3 का मोलर द्रव्यमान g mol-1 में है:
(a) 84.3
(b) 118.6
(c) 11.86
(d) 1186
उत्तर:
(a) 84.3
प्रश्न 21.
एक स्वस्थ प्रौढ़ व्यक्ति के शरीर में सबसे अधिक पाये जाने वाले तत्व का भार है- ऑक्सीजन (61.4%), कार्बन (22.9%), हाइड्रोजन (10.0%) और नाइट्रोजन (2.6% )। एक 75 कि.ग्रा. वजन वाले व्यक्ति के यदि सारे 1H परमाणु 2H परमाणुओं से प्रतिस्थापित हो जायें तो उसका वजन बढ़ेगा:
(a) 37.5 kg
(b) 7.5 Kg
(c) 10 kg
(d) 15 kg
उत्तर:
(b) 7.5 Kg

- RBSE Class 11 Chemistry Important Questions Chapter 2 Structure of Atom
- RBSE Solutions for Class 11 Chemistry Chapter 14 Environmental Chemistry
- RBSE Solutions for Class 11 Chemistry Chapter 13 Hydrocarbons
- RBSE Solutions for Class 11 Chemistry Chapter 12 Organic Chemistry - Some Basic Principles and Techniques
- RBSE Solutions for Class 11 Chemistry Chapter 11 The p-Block Elements
- RBSE Solutions for Class 11 Chemistry Chapter 10 The s-Block Elements
- RBSE Solutions for Class 11 Chemistry Chapter 9 Hydrogen
- RBSE Solutions for Class 11 Chemistry Chapter 8 Redox Reactions
- RBSE Solutions for Class 11 Chemistry Chapter 7 Equilibrium
- RBSE Solutions for Class 11 Chemistry Chapter 6 Thermodynamics
- RBSE Solutions for Class 11 Chemistry Chapter 5 States of Matter